Questões de Concurso Sobre química
Foram encontradas 14.093 questões
Julgue o item quanto à química inorgânica e aos compostos inorgânicos.
A amônia é produzida industrialmente pela reação entre nitrogênio gasoso e hidrogênio gasoso, que se combinam, sob condições apropriadas, de acordo com a equação química a seguir.
N2 (g) + 3 H2 (g) ➝ 2 NH3 (g)
Julgue o item quanto à química inorgânica e aos compostos inorgânicos.
Cátions podem ser formados pela transferência de um
ou mais elétrons, a fim de formar íons positivos. Átomos
não metálicos, por sua vez, tendem a ganhar elétrons
para formar íons negativos, denominados ânions.
Em virtude do decréscimo do comportamento metálico, da direita para a esquerda e da base para o topo na tabela periódica dos elementos, os elementos não metálicos estão localizados na porção superior esquerda da tabela.
No que se refere aos métodos gerais de química orgânica e às propriedades e às características dos compostos orgânicos, julgue o item.
Glicose, frutose e ribose são exemplos de açúcares
naturais. A ribose participa da estrutura dos ácidos
ribonucleicos.
No que se refere aos métodos gerais de química orgânica e às propriedades e às características dos compostos orgânicos, julgue o item.
Pirrol, furano e tiofeno são heterociclopentadienos
aromáticos que têm uma unidade butadieno ligada por
um heteroátomo com hibridação sp². Portanto, tais
moléculas têm pares de elétrons livres deslocalizados.
No que se refere aos métodos gerais de química orgânica e às propriedades e às características dos compostos orgânicos, julgue o item.
Os compostos orgânicos heterocíclicos apresentam, em
sua estrutura, um anel que inclui um heteroátomo,
como o oxigênio, o nitrogênio e o enxofre.
No que se refere aos métodos gerais de química orgânica e às propriedades e às características dos compostos orgânicos, julgue o item.
O composto 1,3,5‐hexatrieno é uma molécula cíclica que
apresenta arranjo com regiões insaturadas conjugadas.
No que se refere aos métodos gerais de química orgânica e às propriedades e às características dos compostos orgânicos, julgue o item.
A espectrometria de ressonância magnética nuclear dá
informações detalhadas sobre a conectividade atômica
das moléculas, testando os núcleos de uma estrutura e
de seus vizinhos, mas sendo restrita aos átomos de
carbono e de hidrogênio.
Considere a imagem abaixo:

A vidraria demonstrada, na imagem, são exemplos de frasco:
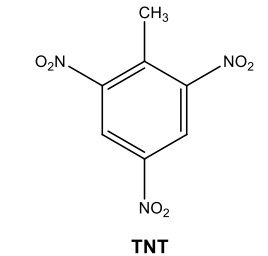
A obtenção desse explosivo, cuja molécula é visualizada acima, é possível devido
( ) Deve-se ligar o exaustor sempre que houver escape de vapores ou gases no laboratório. ( ) As substâncias não utilizadas devem ser retornadas para o frasco de onde foram tiradas. ( ) Ao aquecer um tubo de ensaio contendo qualquer substância, volte à extremidade aberta para si mesmo ou para uma pessoa próxima. ( ) Sempre que proceder à diluição de um ácido concentrado, adicione-o lentamente, sob constante agitação sobre a água e nunca a água sobre o ácido.
Assinale a sequência correta.
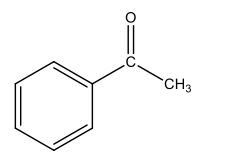
Assinale a alternativa que apresenta o reagente para a síntese dessa molécula
luz e clorofila 6 H2O (I) + 6 CO2 (g) → C6H12O6 (aq) + O2 (g)
Sobre essa reação química, é correto afirmar:
1- Pilha seca comum
( ) Não forma amônia como camada isolante.
2- Pilha alcalina
( ) Sua semirreação catódica é:
2 Ni(OH)3 (s) + 2e → 2 Ni(OH)2 (s) + 2 OH– (aq)
3- Pilha de mercúrio
( ) Emprega sais dissolvidos em solventes não aquosos.
4- Bateria de hidreto metálico
( ) Contém pasta úmida de ZnCl2, NH4Cl e H2O.
5- Bateria de íons lítio
( ) É adequada para dispositivos sensíveis, como aparelhos desurdez, instrumentos científicos e relógios.
Assinale a sequência correta.
CO (g) + CL2 (g) → COCl2 (g)
Sabendo que o grau de equilíbrio é 80%, o cálculo de Kc para esse experimento deverá apresentar o resultado aproximado de
HCI (aq) + KOH (aq) → KCI (aq) + H2O (I)
Após os cálculos, esse pós-graduando concluiu que o pH da solução resultante é igual a:
Dados: αHCl = 100%, Log 5 = 0,7 Massas Molares em g/mol: H = 1; O = 16; Cl = 35,5; K=39,1
Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
2 H2 (g) + 2 NO (g) → N2 (g) + 2 H2 O (v)
A reação foi repetida três vezes, alterando-se a concentração de um ou de ambos os reagentes e mantendo-se a temperatura constante. Os valores de concentração empregados e os valores de velocidade medidos encontram-se na tabela abaixo:

Observando as regularidades entre as concentrações e as velocidades, a lei de velocidade dessa reação deve ser igual a: