Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Observe a fórmula estrutural a seguir, de um composto orgânico.
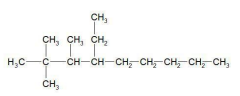
De acordo com as regras da IUPAC, assinale a alternativa que apresenta a nomenclatura correta para este composto orgânico.
Adaptado. Lipídios (artigo) | Macromoléculas | Khan Academy. Acesso em 26 de Julho de 2021.
A seguir, temos as fórmulas estruturais da Vitamina D e do Colesterol.
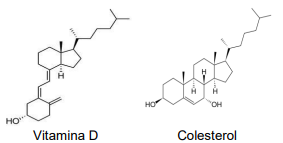
Ao analisarmos as fórmulas estruturais da Vitamina D e do Colesterol, podemos afirmar que ______: Assinale a alternativa que preencha corretamente a lacuna.
Adaptado. Etambutol para a tuberculose – Sahefo (opsana.com). Acesso em 26 de Julho de 2021.
Observe a estrutura do etambutol (C10H24N2O2).
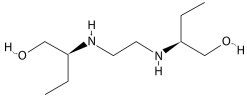
Disponível em: etambutol-img2.jpg (360×190) (indice.eu). Acesso em 26 de Julho de 2021.
Analise a fórmula estrutural do Etambutol, que apresenta efeitos biológicos e propriedades físico-químicas que o faz ser usado como medicamento. Assim, quanto ao Etambutol assinale a alternativa correta.
I. Ao cortamos a legumes em pequenos pedaços aumentamos a velocidade de cozimento, pois interferimos na energia de ativação da reação.
II. Com o aumento da temperatura, elevamos a agitação térmica das partículas e consequentemente o número de colisões, aumentando a velocidade da reação.
III. A presença de um catalisador altera a entalpia da reação, aumentando a sua velocidade.
IV. Ao mastigarmos mais os alimentos, aumentamos a velocidade da digestão, pois aumentamos a superfície de contato.
Estão corretas as afirmativas:
Consideremos uma reação química representada pela equação química genérica e não balanceada, a seguir.
A + B → A2B
Escreva a equação de velocidade para esta reação genérica. Faça o balanceamento, utilizando mínimos coeficientes inteiros. E considere que as ordens de reação em relação aos reagentes sejam iguais aos seus respectivos coeficientes estequiométricos (mínimos coeficientes inteiros).
Assinale a alternativa que apresenta a equação de velocidade para esta reação genérica, após seu devido balanceamento.
Adaptado. Sala BioQuímica: Controle (e descontrole) do pH sanguíneo (salabioquimica.blogspot.com). Acesso em 25 de Julho de 2021.
A seguir, temos as reações de conversão do gás carbônico (CO2) em bicarbonato (HCO3 - ).
CO2 (g) + H2O (l) ↔ H2CO3 (aq) H2CO3 (aq) ↔ HCO3 – (aq) + H+ (aq)
Elas são a base para entendermos o comportamento desse sistema tamponado do sangue nos dois ambientes diferentes: no tecido muscular e nos alvéolos. Assim, de acordo com as características do controle de pH do sistema sanguíneo, assinale a alternativa correta.
Adaptado. CÉLULA A COMBUSTÍVEL, COMO FUNCIONA – Autoentusiastas. Acesso em 20 de Julho de 2021.
A seguir, temos um esquema da célula a combustível de gás hidrogênio.
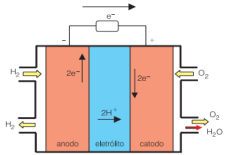
Esquema da célula a combustível de gás hidrogênio. Disponível em: www.usp.br/portalbiossistemas/?p=4316#:~:text=Em outras palavras%2C nessa célula a combustível a,célula a combustível é%3A H2 %2B ½O2→ H2O. Acesso em 20 de Julho de 2021.
A reação global balanceada da célula a combustível de gás hidrogênio é:
H2 (g) + ½O2 (g) → H2O (g)
Analisando o esquema da célula a combustível de gás hidrogênio (acima) e sua reação global balanceada, assinale a alternativa correta.
Os polímeros são grandes moléculas que apresentam unidades que se repetem, chamadas monômeros. Tais moléculas podem ser encontradas na natureza ou produzidas em laboratório, através de reações de polimerização. Uma das principais e mais importantes características dos polímeros é a resistência mecânica. E segundo ela, os polímeros podem ser divididos em termoplásticos, termoendurecíveis (termofixos) e elastômeros (borrachas). Um exemplo de plástico termofixo são as resinas epóxi. Elas são base para diversas aplicações e produtos industriais, sendo empregadas na fabricação de tintas, materiais compósitos, adesivos de engenharia de alta performance, fabricação de aviões, automóveis, bicicletas, barcos, snowboards, colagem de madeiras, metais, vidros e pedras, sob condições ambientais de temperatura e pressão. Além da fabricação de circuitos eletroeletrônicos, pois são protetores de componentes de pequenos circuitos, como resistores, transistores e capacitores.
Adaptado. g5.pdf (unicamp.br). Acesso em 25 de Julho de 2021.
A seguir, apresentamos a sua fórmula
estrutural.
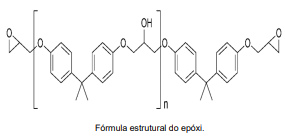
Analisando a fórmula estrutural do epóxi, assinale a alternativa correta.
Observe a tabela a seguir. Temos quatro reações (I, II, III e IV) e seus respectivos produtos.
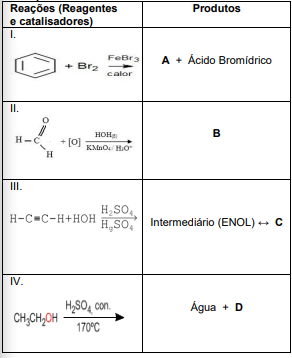
Analise as reações (I, II, III e IV) representadas
na tabela acima. Observe suas características
e sua classificação. Assinale a alternativa que
relaciona corretamente a reação e seu
respectivo produto (A, B, C e D),
respectivamente.
I. Estimular a instalação de equipamentos que monitoram e diminuem a toxicidade dos gases que são lançados na atmosfera por diversas indústrias pode reduzir a precipitação de chuvas ácidas. II. Evitar a liberação de monóxido de carbono que reage com a água, formando ácido carbônico, um dos principais responsáveis pelo aumento da acidez das chuvas, pode dificultar a precipitação de chuvas ácidas. III. Diversificar a matriz energética por meio da oferta e do uso de fontes renováveis ou alternativas de energia, diminuindo o lançamento de gases na atmosfera resultantes da queima de combustíveis fósseis pode inibir a precipitação de chuvas ácidas. IV. Dificultar a chegada da chuva ácida ao solo, evitando a neblina, que é o principal formato úmido da chuva ácida, responsável pela contaminação e desgaste dos solos, pode amenizar os efeitos negativos da precipitação ácida sobre as plantações.
Estão corretas as afirmativas:
- O gás é formado por moléculas que se encontram em movimento desordenado e permanente. Cada molécula pode ter velocidade diferente das demais. - Cada molécula do gás interage com as outras somente por meio de colisões (forças normais de contato). A única energia das moléculas é a energia cinética. - Todas as colisões entre as moléculas e as paredes do recipiente que contém o gás são perfeitamente elásticas. A energia cinética total se conserva, mas a velocidade de cada molécula pode mudar. - As moléculas são infinitamente pequenas. A maior parte do volume ocupado por um gás é espaço vazio.
Seguindo estes quatro postulados, Boltzmann e Maxwell mostraram a relação entre a energia cinética média do total de moléculas de um gás ideal e sua temperatura conforme a expressão:
PV = 2/3 N { ½ m[v 2 ]} ½ m[v 2 ] = 3/2 kT Onde: N = número de moléculas; k (constante de Boltzmann) = 1,38.10 -23 J/K; T = temperatura absoluta (Kelvin)
Considere que o gás seja ideal, mantido em um recipiente isolado e fechado hermeticamente, e assinale a alternativa correta de acordo com a teoria cinética dos gases.
Neste trecho da música do Emicida, a preocupação com o uso dos recursos naturais é notória. E nos faz refletir sobre as questões ambientais e suas implicações tecnológicas, sociais e científicas que fazem parte da nossa vida pessoal e profissional. Sendo assim, assinale a alternativa que apresenta quais problemáticas ambientais podemos relacionar ao trecho da música Passarinhos, de Emicida.
Adaptado.Produção de Alumínio: Extração da Bauxita, Obtenção na Eletrólise (culturalivre.com). (Acesso em 24 de Julho de 2021).
Podemos resumir a reação de obtenção do alumínio a partir do óxido de alumínio por meio da seguinte equação química balanceada. 2 Al2O3 (l) + 3 C(s) → 4 Al (l) + 3 CO2 (g) Dados: Massas atômicas (g/mol) Al=27; C=12; O=16. Assinale a alternativa que apresenta a massa, em gramas, de alumínio produzida se tivermos o triplo da quantidade, em mol, de óxido de alumínio e carvão.
Adaptado. Pilhas e Baterias de Lítio. Pilha e Baterias de íon lítio (uol.com.br). (Acesso em 23 de Julho de 2021).
Com relação à pilha de lítio usada em marca-passos e as transformações nela ocorridas, assinale a alternativa correta.
- O ar expelido pelos pulmões do suspeito é bombeado em uma solução de dicromato de potássio fortemente acidulada (ácido sulfúrico); - O etanol presente na boca do motorista (se este consumiu bebida alcoólica) reage com os íons dicromato da solução, produzindo acetaldeído e íons Cromo (III); - Em razão da reação química, ocorre uma mudança na cor da solução, a cor característica laranja passa para um tom esverdeado, acusando a presença de álcool etílico ou etanol.
Adaptado. Composição química do Bafômetro - Mundo Educação (uol.com.br). (Acesso em 23 de Julho de 2021)
A reação que ocorre no bafômetro com dicromato de potássio está representada pela equação química não balanceada a seguir:
K2Cr2O7(aq) + x H2SO4(aq) + 3CH3CH2OH(g) → alaranjado incolor
Cr2(SO4)3(aq) + y H2O(l) + 3CH3CHO(g) + K2SO4(aq) verde incolor
Assinale a alternativa que relaciona a classificação e os respectivos valores de x e y (mínimos coeficientes inteiros) que balanceiam corretamente a reação do bafômetro com dicromato de potássio.
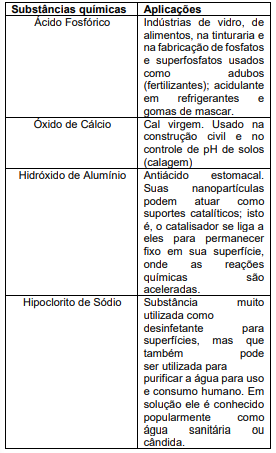
Assinale a alternativa que apresenta as fórmulas químicas que representam as substâncias presentes na tabela acima.
Adaptado.https://www.embrapa.br/documents/1355126/49258452/e mbrapa.br-Corre%C3%A7%C3%A3o+do+Solo+- +Portal+Embrapa.pdf/8a01a49d-0b94-c4e4-ea38- 5682ceb37955. (Acesso em 23 de Julho de 2021).
O processo de calagem do solo citado anteriormente no texto refere-se à utilização de calcário (CaCO3) para diminuir a acidez dos solos. Assim, quando o carbonato de cálcio é adicionado ao solo, ele pode reagir de vários modos. Assinale a alternativa que apresenta as equações químicas que podem ocorrer neste processo.
Adaptado. Chapter 9 Molecular Geometries and Bonding Theories (ufpr.br). (Acesso em 23 de Julho de 2021).
Observe a tabela a seguir. E assinale a alternativa que apresenta a sequência que relaciona corretamente a substância ou o íon à sua geometria molecular, respectivamente.
Substâncias/íons Geometria Molecular I. NH3 ( ) Angular II. PH4+ ( ) Linear III. H2O ( ) Tetraédrica IV. CO2 ( ) Piramidal
Dados: Números atômicos (Z) H = 1; C = 6; N = 7; O = 8; P =15.
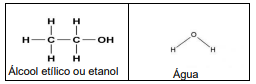
Após observar as fórmulas estruturais do etanol e da água, reconhecemos que o etanol se dissolve em água devido à formação de______:
Assinale a alternativa que preencha corretamente a lacuna.