Questões de Concurso Sobre química
Foram encontradas 14.919 questões
CaCO3(s) ⇌ CaO(s) + CO2(g)
sabendo que cada uma das seguintes misturas (ou uma dada substância) está contida em um recipiente fechado sob determinada temperatura e em repouso.
A dependência da cinética química em relação à temperatura tem sido estudada extensivamente. Para diversas reações, uma relação empírica, chamada de equação de Arrhenius, pode ser usada para descrever a dependência da constante de velocidade (k) em relação à temperatura:
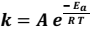
Nessa equação, Ea é a energia de ativação, R é a constante dos gases, T é a temperatura absoluta e A, o fator de frequência (considerado aproximadamente constante). Com base nessa relação empírica descrita, assinale a alternativa correta.
Assinale a alternativa que classifica corretamente os seguintes elementos, em ordem crescente de raio atômico: ferro, potássio, rubídio, enxofre e selênio.
Observação: utilize apenas a tabela periódica para a resolução.
Observação: considere a densidade da solução igual a 1,0 g/mL.
Diante do exposto, assinale a alternativa correta.
Dados: Kps AgCl = 1,8x10-10; Kps PbCl2 = 1,7x10- 5 ; √8,5 = 2,9
4 Ag(s) + O2(g) + 4 H+ (aq) → 4 Ag+ (aq) + 2 H2O(l)
Com base nessa reação, o valor da variação de energia livre de Gibbs padrão (ΔG0) é, aproximadamente, igual a
Dados: E0 Ag+/Ag0 = −0,80 V; E0 O2(g)/H2O = 1,23 V; Constante de Faraday (F) = 96500 C mol-1
Acerca de radioatividade, de biomoléculas e de aplicações da química em sabões e detergentes, julgue o item.
Uma das principais aplicações da química para a higiene
é a produção de sabões e detergentes. Na reação de
saponificação, ocorre a hidrólise básica de uma gordura
ou de um óleo, formando o glicerol e um sabão.
Acerca de radioatividade, de biomoléculas e de aplicações da química em sabões e detergentes, julgue o item.
A biomolécula proteína é um grande agregado de
aminoácidos e um composto orgânico natural que se
dissolve em hidrocarbonetos, mas não em água, ou seja,
as proteínas são ésteres sólidos ou semissólidos de
glicerol e ácidos graxos.
Acerca de radioatividade, de biomoléculas e de aplicações da química em sabões e detergentes, julgue o item.
A radioatividade é a emissão espontânea de radiação
por núcleos radioativos, ou seja, a desintegração ou a
decomposição de núcleos atômicos. Assim, um núcleo é
radioativo se ele pode mudar sua estrutura
espontaneamente e emitir radiação.
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
O termo pilha é empregado para se referir a um
dispositivo constituído de dois eletrodos e um eletrólito,
arranjados de maneira a produzir energia elétrica.
Quando os eletrodos são conectados a um aparelho
elétrico, uma corrente flui pelo circuito, pois o material
de um dos eletrodos oxida-se espontaneamente,
liberando elétrons (ânodo), enquanto o material do
outro eletrodo reduz-se, usando esses elétrons (cátodo).
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
Uma solução-tampão resiste a mudanças de pH quando
um ácido ou uma base são adicionados. Um tampão
ácido estabiliza soluções em pH maior que 7 e um
tampão básico estabiliza soluções em pH menor que 7.
Uma solução que contenha CH3COOH e CH3CO2− é um
típico tampão básico.
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
O equilíbrio químico é o estado em que duas ou mais
fases de uma mesma substância coexistem, sem que
haja tendência à mudança. Pelo princípio de Le
Chatelier, quando uma tensão ocorre nesse sistema em
equilíbrio, ele se ajusta para maximizar o efeito da
tensão, ou seja, quando o sistema em equilíbrio é sujeito
a uma perturbação, tende a aumentar o efeito
perturbador, distanciando-se da condição de equilíbrio.
Com relação à termoquímica, à entropia, à espontaneidade de reações e à cinética química, julgue o item.
Um catalisador é uma substância ou espécie que
aumenta a velocidade de uma reação sem ser
consumida, fornecendo um mecanismo alternativo de
baixa energia de ativação para a reação. Um catalisador
é homogêneo quando está na mesma fase dos reagentes
e é heterogêneo se está em uma fase diferente da dos
reagentes.