Questões de Concurso Sobre química
Foram encontradas 13.485 questões
Com relação ao assunto do texto anterior, julgue o item seguinte.
O gás hidrogênio é um gás nobre.
Com relação ao assunto do texto anterior, julgue o item seguinte.
A presença do oxigênio faz o NaOH ser classificado como
óxido.
Para serem preparados 100 g de uma solução de etanol em água a 45,5 °INPM por diluição da solução de 70 °INPM, serão utilizados 65 mL dessa última solução.
O álcool é o solvente na solução de 92 °INPM.
Ao se misturarem 30 g da solução de 92 °INPM com 50 g da solução de 70 °INPM, é obtida uma solução de etanol com concentração maior que 80 °INPM.
A concentração, em quantidade de matéria, da solução de 70 °INPM é maior que 13 mol/L.
A solução de álcool de 92 °INPM é uma solução supersaturada, a de 70 °INPM é uma solução saturada, e a de 46 °INPM é uma solução insaturada.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Em geral, o desvio do comportamento ideal de um gás é mais evidenciado em pressões mais altas e em temperaturas mais baixas.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

O fato de o NaCl fundir-se a 801 °C e o MgO fundir-se a 2.852 °C é uma evidência de que os sólidos iônicos são unidos por interações entre cátions e ânions, isto é, ligações iônicas.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Os sólidos iônicos são cristalinos, e os sólidos moleculares são amorfos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, o segmento de curva entre os pontos O e T representa a curva de sublimação, que separa a fase sólida da fase gasosa, e cada ponto desse segmento é uma condição de equilíbrio entre o sólido e o gás.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

No gráfico apresentado, os processos indicados pelas setas I e IV representam, respectivamente, os processos de vaporização e congelamento da referida substância.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

Nos líquidos, a ordem de ligação tem mais curto alcance que nos sólidos cristalinos.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

As moléculas se organizam por meio de ligações covalentes entre si para formar os sólidos moleculares.
Uma das principais vantagens da teoria de ligação de valência é a possibilidade de explicar, satisfatoriamente, fenômenos associados a estados de excitação e de prever os espectros de absorção e emissão de energia eletrônica das moléculas.
Nos compostos formados por cátions e ânions muito polarizáveis, o caráter da ligação química é fortemente covalente.
A molécula de N2H2 é linear e nela há uma dupla ligação entre os átomos de nitrogênio, sendo cada átomo de hidrogênio ligado a um dos átomos de nitrogênio.
De acordo com a teoria de ligação de valência, a molécula de água é constituída por quatro orbitais híbridos do tipo sp3 arranjados de forma tetraédrica em torno do oxigênio, de maneira que dois orbitais participam das ligações simples O–H e outros dois acomodam os pares de elétrons não ligantes.
De acordo com a teoria de ligação de valência, o diagrama de orbitais para o átomo de Be, para formar orbitais híbridos no BeF2, está corretamente representado na figura a seguir.
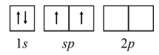
O comprimento da ligação entre o hidrogênio e o átomo de halogênio é maior no HI que no HF.