Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Considerando essa situação e o fato de que o experimento de titulação é uma das formas de se avaliar se uma solução apresenta propriedade tamponante, assinale a opção correta.
pH = –log10[H+]
Considerando que uma amostra de sangue apresenta uma concentração iônica [H+] de 100,61 × 10–8 mol/L, qual é o pH dessa amostra de sangue?
m = 20/ (152g.mol).(1.0) m = 0,13
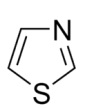
Qual tipo de isomeria a figura representa?
A formação da chuva está relacionada às mudanças de estado físico da água.
Considere as seguintes afirmativas referentes às mudanças de estado físico da água.
I – Condensação é a mudança da substância, do estado gasoso para o estado líquido.
II – Evaporação é a mudança da substância, do estado líquido para o estado gasoso.
III - Fusão é a mudança da substância, do estado sólido para o estado gasoso.
IV – Solidificação é a mudança da substância, do estado sólido para o estado líquido.
São verdadeiras, apenas, as seguintes afirmativas:
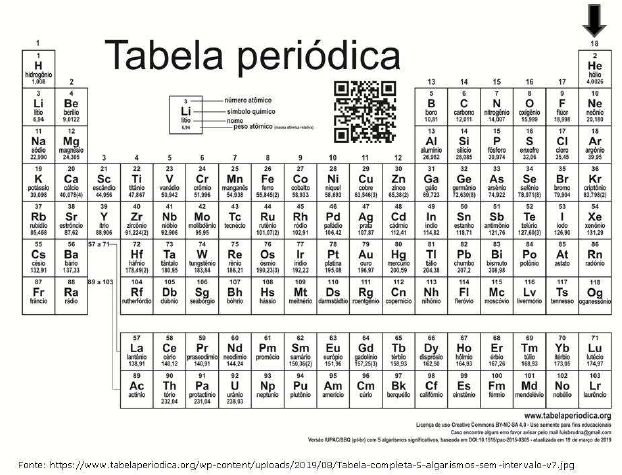
 A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal:
A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal: 
Considerando as informações da figura, pode-se afirmar corretamente que:
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
