Questões de Concurso Sobre química
Foram encontradas 13.542 questões
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
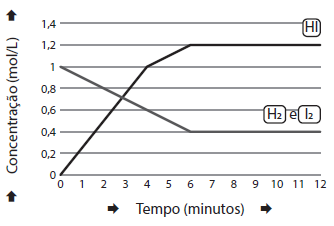
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
Considerando os seguintes dados, calcule o calor de combustão do etino, C2 H2, conhecido comercialmente como acetileno.
2C(grafite) + H2 (g) → C2 H2 (g) ∆Hf0 = +226,73 kJ.mol–1
C(grafite) + O2 (g) → CO2 (g) ∆Hf0 = –393,51 kJ.mol–1
H2 (g) + ½O2 (g) → H2 O(l) ∆Hf0 = –285,83 kJ.mol–1
O calor de combustão do acetileno, (∆Hr0 ), é:
Considere certa reação química, representada pela equação genérica abaixo:
A + B → Produtos
Na temperatura de 20°C, apresenta um lei de velocidade (V1 ), V1 = k.[A].[B].
Qual será a sua lei de velocidade (v2 ) na temperatura de 30°C, admitindo-se que essa reação obedece ao princípio de Van’t Hoff, nas mesmas concentrações iniciais dos reagentes.
Analise as afirmativas a seguir:
1. A massa atômica de certo elemento que é apresentada na tabela periódica corresponde à média ponderal das massas atômicas dos seus isótopos naturais.
2. Os nêutrons são partículas subatômicas com carga positiva e têm aproximadamente a mesma massa do elétron.
3. Os isótopos de um elemento têm o mesmo número atômico, mas diferentes números de massa.
4. Para um elemento neutro, a soma do número de prótons e de nêutrons corresponde ao seu número de massa.
5. A disposição dos elementos na tabela periódica está baseada no número atômico do elemento que corresponde à soma dos seus prótons e de seus elétrons.
Assinale a alternativa que indica todas as afirmativas corretas.

A partir dos dados extraídos do gráfico responda aos itens abaixo:
Admitindo-se que, para uma certa reação, o segmento AB representa o nível da entalpia dos reagentes e o segmento FG o nível da entalpia dos produtos, podemos afirmar que:
1. A reação direta é exotérmica.
2. A energia de ativação desse processo é representada pelo segmento FG. 3. O perfil do gráfico permite afirmar que a reação direta representa uma reação de combustão. 4. A variação de entalpia (energia) de reação direta é de ΔH = – 600,00 kJ. 5. A reação inversa é exotérmica.
Assinale a alternativa que indica todas as afirmativas corretas.
Quando o dicromato de sódio, Na2 Cr2 O7 , numa reação química se transforma em sulfato de crômio, Cr2 (SO4 ) 3 , cada átomo de crômio:
Considere: Massa Molar NaF= 42 e F= 19.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
A troca iônica é um processo no qual os íons presos em
uma resina trocadora de íons (um sólido poroso
insolúvel) são trocados por íons presentes em uma
solução que é levada ao contato com o sólido. Resinas
trocadoras de íons têm aplicação no processo de
desionização de água, na purificação de soluções e na
separação de íons.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
A cromatografia é um método que permite a
identificação e a determinação de componentes em
misturas complexas, com base nas diferenças de
velocidade em que são transportados por meio de uma
fase móvel sólida, líquida ou gasosa. Na cromatografia
gás‐líquido, um gás transporta a amostra sobre uma fase
sólida estacionária, com a adsorção dos componentes
separados em diferentes graus.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
Saponificação é a reação de hidrólise básica de uma
gordura ou óleo, em que são formados glicerol e um
sabão. Nessa reação, ocorre a clivagem de um grupo
éster para regenerar o álcool e o ácido dos quais o éster
foi derivado, ou seja, é o processo no qual um éster é
hidrolisado em solução alcalina para formar um álcool e
uma base conjugada.
No que diz respeito a reações orgânicas e a métodos de separação, julgue o item
Os álcoois terciários, em que o carbono que possui o
grupo hidroxila faz três ligações com outros átomos de
carbono, sofrem oxidação pelo ataque de oxigênio
nascente, formando primeiramente um aldeído, seguido
pelo ataque de outro oxigênio nascente no carbono da
carbonila, produzindo um ácido carboxílico.
Quanto a compostos orgânicos e a reações de caracterização, julgue o item
Um dos métodos para caracterização dos fenóis se
baseia no teste com cloreto de ferro (III). Nesse teste, os
fenóis formam complexos incolores, nos quais ocorre
uma reação de complexação entre a hidroxila fenólica e
o íon Fe3+. Como o FeCl3 possui coloração amarela, a
ausência de cor indica a presença de fenol.
Quanto a compostos orgânicos e a reações de caracterização, julgue o item
A identificação de compostos insaturados é possível por
meio das reações de adição. No método com adição de
bromo em tetracloreto de carbono, o teste será positivo
se a solução se descolorar imediatamente, com
formação de precipitado marrom. No teste com
permanganato, será positivo se ocorrer a descoloração
da solução, que é avermelhada. Ambos os testes
confirmam a presença de insaturação.
Quanto a compostos orgânicos e a reações de caracterização, julgue o item
As moléculas de propanal e propanona são exemplos de
compostos orgânicos isômeros. Ambos apresentam a
mesma fórmula molecular, C3H6O.
Quanto a compostos orgânicos e a reações de caracterização, julgue o item
Amida é a classe de compostos orgânicos formados na
reação de uma amina com um aldeído, em que um grupo
hidroxila foi substituído pelo grupo amino ou um grupo
amino substituído.
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
ma substância cujas soluções aquosas contêm íons é
chamada de eletrólito. Uma substância que não forma
íons em solução é chamada não eletrólito. Por exemplo,
as diferenças entre soluções contendo cloreto de sódio
e sacarose devem‐se, em grande parte, ao fato de o NaCl
ser iônico, enquanto o C12H22O11 é molecular.