Questões de Concurso Sobre química
Foram encontradas 13.542 questões
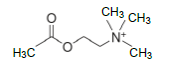
é correto afirmar que este composto:
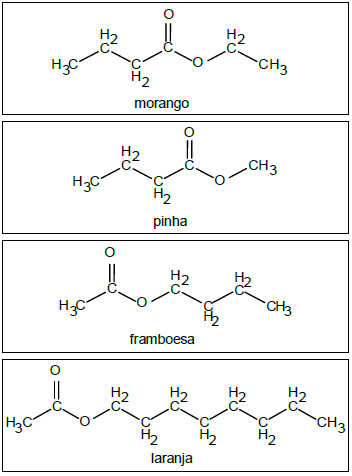
Segundo as regras de nomenclatura da IUPAC, os nomes corretos das essências de morango, pinha, framboesa e laranja são, respectivamente:
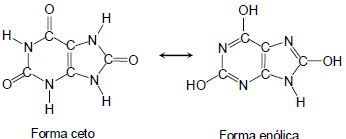
De acordo com a forma enólica do ácido úrico, é correto afirmar que:
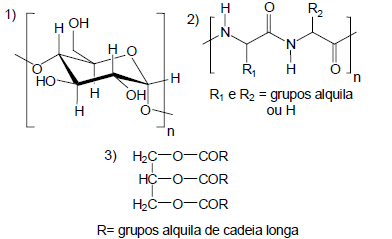
1, 2 e 3 são os principais constituintes nutricionais dos alimentos a seguir, respectivamente:
(CH3)3C-Br(l) + OH- (aq) → (CH3)3C-OH(l) + Br- (aq)
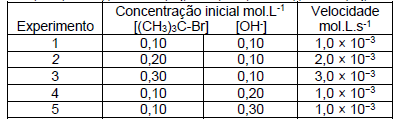
A partir dos dados fornecidos, assinale a alternativa que indica a equação da velocidade e a ordem da reação corretas.

De acordo com os potenciais de redução descritos, assinale a alternativa correta.

Quando 1 mol de oxigênio molecular é consumido, quantos mols de elétrons são transferidos nesta reação redox?
T = 19 prótons e 21 nêutrons.
X = 19 prótons e 20 nêutrons.
Y = 20 prótons e 19 nêutrons.
Z = 20 prótons e 20 nêutrons.
Com base nessas afirmações, assinale a alternativa correta.
Coluna - 1 (pares de substâncias) (I) Cloreto de sódio e glicose (II) Naftaleno e sacarose (III) Nitrato de sódio e bicarbonato de sódio
Coluna - 2 (testes) (X) pH de suas soluções aquosas (Y) Dissolução em água (Z) Condutividade de suas soluções aquosas
Quais os testes (Coluna - 2) devem ser usados para distinguir os pares de substâncias em I, II e III, (Coluna - 1), respectivamente.
2 Al(s) + 2 KOH(aq) + 6 H2O(l) → 2 KAl(OH)4(aq) + 3 H2(g) (etapa 1)
2 KAl(OH)4(aq)+ H2SO4(aq) → 2 Al(OH)3(s) + 2 H2O(l) + K2SO4(aq) (etapa 2)
2 Al(OH)3(s)+3 H2SO4(aq)+K2SO4(aq) → 2 KAl(SO4)2(s) + 6 H2O(l) (etapa 3)
a Al(s)+b KOH(aq)+c H2SO4(aq) →d KAl(SO4)2(s)+e H2O(l)+f H2(g) (reação total)
Após realizar o balanceamento da equação da reação total, assinale a alternativa que indica o somatório dos índices (a+b+c+d+e+f).
Para o sistema em equilíbrio abaixo:

são dados os valores de constante de equilíbrio, Kc, em diferentes temperaturas:
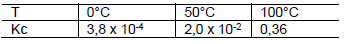
De acordo com os dados fornecidos, é correto afirmar:
1 C4H10(g) + 13/2 O2(g) → 4 CO2(g) + 5 H2O(g)
Calcule o calor liberado na reação acima, a 298 K, a partir das entalpias-padrão de formação, ΔHfº , a 298 K.


Para tornar a produção de H2(g) mais eficiente, devemos:
MgO(s) + 2 HCl(aq) → MgCl2(aq) + H2O(l)
Calcule a massa de óxido de magnésio necessária para neutralizar 0,06 mol de ácido clorídrico contido no estômago de uma pessoa.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Cl = 35,5; Mg = 24,3.
Dados: massas molares em g.mol-1 : C = 12; O = 16. Volume molar dos gases a 1 atm e 30°C = 25 L.mol-1 . Solubilidade do CO2(g) no refrigerante a 5°C e sob 1 atm de CO2(g) = 3,0 g.L-1 .
Em uma batida de trânsito, a dosagem de álcool no sangue de um indivíduo mostrou o valor de 0,080 g por 100 mL de sangue. Supondo que o volume total de sangue desse indivíduo seja 6,0 L, e admitindo que 12% do álcool ingerido se encontra no seu sangue, quantas doses de bebida alcoólica ele deve ter tomado?
Dados: 1 dose de bebida alcoólica = 20 g. Porcentagem em gramas de etanol na bebida 40%.
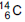 (emissor de partículas
(emissor de partículas 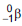 com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação:
com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação: 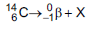
Qual é a substância X formada após a desintegração do isótopo
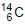 ?
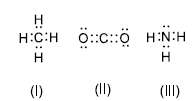
?De acordo com as estruturas de Lewis das moléculas, representadas abaixo, suas geometrias são, respectivamente: