Questões de Concurso Sobre química
Foram encontradas 13.542 questões
Com relação à descrição do texto acima, três afirmações foram feitas:
1) A adsorção é a propriedade que certos materiais têm de reter partículas (íons ou moléculas) de outros materiais em sua superfície.
2) A absorção é a propriedade que certos materiais têm de reter partículas (íons ou moléculas) de outros materiais em seu interior.
3) A platina metálica é muito utilizada como catalisador em reações de hidrogenação devido à propriedade de absorção do gás hidrogênio.
Está(ão) correta(s) a(s) afirmativa(s):
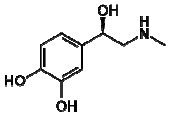
analise as seguintes afirmações.
1) A adrenalina apresenta os grupos funcionais fenol e amida.
2) É um composto aromático e apresenta isomeria ótica.
3) Apresenta uma amina secundária.
Está(ão) correta(s):
4 Au(s) + 8 NaCN(aq) + O2(g) + 2 H2O(l) → 4 NaAu(CN)2(aq) + 4 NaOH(aq)
Com relação à reação acima, podemos afirmar que:
1. O NOX do Au varia de zero para +1; assim, o ouro sofre oxidação e, portanto, é o agente redutor.
2. É uma reação redox, mas não há variação no número de oxidação do sódio.
3. Cada mol de O2 recebe 4 mol de elétrons.
Está(ão) correta(s) a(s) afirmativa(s):
CO(g) + CH3OH(l) → CH3COOH(l).
Utilizando os valores das entalpias de formação padrão da tabela a seguir, calcule a entalpia padrão da reação, ∆H°, e determine se a mesma é endotérmica ou exotérmica.
Composto Entalpia de formação ∆Hf°, kJ.mol−1
CO(g) −110,53
CH3OH(l) −238,86
CH3COOH(l) −484,50
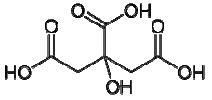
três afirmações foram feitas:
1) A molécula do ácido cítrico apresenta três carbonos com hibridização sp2 .
2) O citrato de sódio é um composto iônico com fórmula química C6H5Na3O7.
3) O fosfato de cálcio tem fórmula Ca2(PO4)3.
Está(ão) correta(s) a(s) afirmativa(s):
X: 1s2 Y: 1s2 2s2 2p5 Z: 1s2 2s2 2p6 3s2 3p5
Com relação a esses elementos químicos (X, Y e Z), as seguintes afirmações foram feitas:
1) X apresenta a maior energia de ionização. 2) Y e Z apresentam o mesmo raio atômico. 3) Y e Z pertencem ao mesmo grupo da Tabela Periódica.
Está(ão) correta(s) a(s) afirmativa(s):
1) Areia e sal de cozinha 2) Areia e ar 3) Água e sal de cozinha 4) Óleo de soja e água
( ) Filtração ( ) Destilação ( ) Dissolução seguida de filtração ( ) Decantação
A sequência correta é:
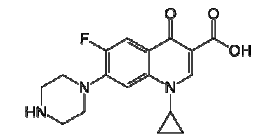
é correto afirmar que a molécula da ciprofloxacina possui:
x C15H10O7(s) + y O2(g) → z CO2(g) + w H2O(g).
Após balancear a referida equação com os menores números inteiros possíveis, a soma dos coeficientes estequiométricos é:
Dados: Massas molares em g . mol−1 : O = 16; K = 39; Cr = 52.
Al3+(aq) + 3 e− → Al(s) E°= -1,66 V Pb2+(aq) + 2 e− → Pb(s) E°= -0,13 V
Calcule o potencial-padrão, ∆E°, da célula galvânica (pilha) e assinale a alternativa correta.
A região de Mariana (MG) é reconhecida pela atividade de extração de minério de ferro. No processo, impurezas e substâncias químicas são destinadas a uma barragem de rejeitos, onde ficam retidas e formam uma espécie de lama. Em 2015, com o rompimento da barragem da Samarco, em Mariana, 62 milhões de m3 de dejetos foram despejados provocando o maior desastre ambiental do país: arrasou um ecossistema, matou 13 pessoas, deixou milhares sem casa e continua colocando em risco o organismo da população. A lama tóxica representa grande perigo à saúde das comunidades, pois contém metais pesados como arsênio, mercúrio e chumbo, além de alumínio. (Revista Saúde - Editora Abril, dezembro de 2015, pgs. 50 e 51).
Sobre os metais citados acima, é correto afirmar que:
Leia atentamente os textos 1 e 2: Texto 1: “Em 1869, um professor da Universidade de São Petersburgo, o russo Dmitri Mendeleev (1834–1907), concebeu um diagrama em que ordenava cerca de 60 elementos químicos então conhecidos em função de sua respectiva massa. Essa foi a primeira versão do que viria a ser conhecida como a moderna tabela periódica, hoje composta de 118 elementos, dispostos em 18 grupos (colunas) e 7 períodos (linhas).”
Fonte: Disponível em: https://revistapesquisa.fapesp.br/2019/03/14/a-encruzilhadada-tabela-periodica/. Acesso em 19 jun. 2019). 18
Texto 2:
“Você já ouviu falar do ununênio? Ununênio, ou mesmo Eka-Frâncio, é como se chama, provisoriamente, aquele que será o elemento de número atômico 119 da tabela periódica. Ele se localizará na família dos metais alcalinos, se assemelhando ao lítio, sódio, potássio, rubídio, césio, e frâncio, sendo responsável por iniciar o oitavo período da tabela de Henry Moseley e representado pelo símbolo Uue.”
Fonte: Disponível em: http://www.petquimica.ufc.br/ununenio-um-elemento-aindanao-sintetizado/. Acesso em 19 jun. 2019
Os textos 1 e 2 referem-se à disposição dos elementos químicos inseridos nos
últimos anos na atual Tabela Periódica e mencionam que estes encontram-se,
respectivamente, nos 7º e 8º períodos. Indique a alternativa abaixo que melhor
define os períodos na Tabela Periódica:
A respeito da energia livre de Gibbs, quando um processo ocorreu à pressão e temperatura constantes, um químico fez as seguintes ponderações:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea.
Estão corretas as ponderações