Questões de Concurso Sobre química
Foram encontradas 14.919 questões
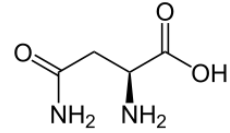
De acordo com sua fórmula estrutural abaixo, assinale a alternativa CORRETA.
Considerando que não há perda de massa no sistema e que a coluna opera em regime estacionário, qual é a fração aproximada de recuperação de A na corrente do destilado?
Dados: MM (Ca) = 40,07 g/mol MM (CaO) = 56,07 g/mol
I. Pb(NO3)2 (aq) + 2 KI (aq) ➔ 2 KNO3 (aq) + PbI2 (s)
II. A molaridade dos íons Pb2+(aq) e I – (aq) após a mistura continua a ser de 0,2 M.
III. Não haverá precipitação de PbI2 após a mistura.
Está CORRETO o que se afirma em
Solução A (tampão) pH = 5
Solução B (não-tampão) pH = 5
I. O pH da solução A não sofrerá nenhuma variação.
II. O pH da solução B irá aumentar.
III. O pH da solução A será menor do que o pH da solução B.
Está CORRETO o que se afirma em
Dados: Ka (CH3COOH) = 1 x 10–5 Kw = 1 x 10–14
Dado: log 2 = 0,30
2 H2O ⇌ H3O+ + OH–
Devido à elevada concentração de água em soluções diluídas, é possível determinar a constante Kw, conhecida como produto iônico da água.
Com isso em mente, analise as proposições a seguir:
I. O valor de Kw é sempre igual a 1 x 10-14 para qualquer temperatura.
II. Como os íons OH- e H3O+ são formados exclusivamente pela dissociação da água, suas concentrações devem ser iguais em uma amostra de água pura.
III. O valor de Kw pode ser relacionado à concentração molar do íon hidróxido por meio da seguinte equação, válida para uma amostra de água pura: [ OH - ] = √ Kw
Está CORRETO o que se afirma em
Adaptado de: MENDA, M. Plásticos. Conselho Regional de Química – IV Região. Disponível em: https://www.crq4.org.br/quimicaviva_plasticos
Segundo o texto, a reciclagem dos termoplásticos é um exemplo de fenômeno
I. A água utilizada para preparar soluções de base deve ser livre de dióxido de carbono.
II. Quando a água utilizada no preparo da base é supersaturada com o dióxido de carbono, ela deve ser congelada brevemente para eliminar o gás.
III. Um frasco de polietileno, tampado firmemente, pode fornecer a curto prazo uma proteção adequada contra a absorção de dióxido de carbono atmosférico por soluções padrão de base.
IV. Depois de longos períodos de armazenagem, as soluções de hidróxido de sódio tornam os frascos de polietileno quebradiços.
V. Soluções de hidróxido de sódio podem diminuir a concentração quando estocados em recipientes de vidro.
Sobre as afirmativas acima, pode-se declarar que está CORRETO o que está contido em
a ordem de ponto de ebulição é:
I. Extração por solvente
II. Destilação
( ) Requer energia térmica.
( ) Indicada quando os componentes a serem separados possuem a mesma volatilidade.
( ) Indicada quando os componentes são termicamente instáveis.
( ) Utiliza as diferenças de pressão de vapor dos componentes da mistura para efetuar a separação.
( ) A diferença de solubilidade dos componentes é fator determinante na separação.
Assinale a sequência CORRETA que preenche os parênteses de cima para baixo: