Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Considere a lista de vidrarias a seguir:
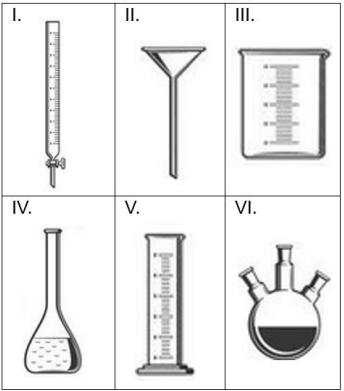
São vidrarias que NÃO podem ser secadas sob condições de aquecimento em estufa de circulação forçada as contidas nos itens:
I. Compostos orgânicos como açúcares, amido, aminoácidos e ácido cítrico podem ser descartados no lixo comum.
II. Soluções ácidas de dicromato de potássio, desde que devidamente neutralizadas com hidróxido de sódio, podem ser descartadas na pia sob água corrente.
III. Os resíduos devem ser separados em categorias, considerando-se as características físico-químicas, periculosidade e compatibilidade química, por exemplo.
IV. Soluções de metais pesados podem ser tratadas com solução alcalina em excesso, sendo a mistura descartada em recipientes apropriados para posterior destinação adequada.
V. Os resíduos de bases devem ser descartados em recipientes de vidro borossilicato.
Marque a alternativa CORRETA:
Dados os seguintes valores de massas molares (g/mol): CaCO3: 100; HCl: 36,5; NaOH: 40.
I) ( ) Os equipamentos comuns de segurança e emergência incluem extintores, kit de primeiros socorros, estação de lavagem de olhos e chuveiros de emergência e saídas de emergência.
II) ( ) Um lava-olhos e um chuveiro de emergência devem estar acessíveis a todo o momento nos laboratórios onde reagentes perigosos para a pele e os olhos são usados.
III) ( ) Os laboratórios devem estar equipados com um número suficiente de extintores de incêndio independentemente do tipo de materiais que estão sendo manipulados.
IV) ( ) No caso de acidentes com exposição da pele a produtos químicos, a maneira correta a proceder é lavar a área afeta com sabão ou detergente por 15 a 20 minutos em água corrente.
V) ( ) Encaminhar a pessoa ao hospital se a irritação persistir e se houver um dano aparente ou se as normas de segurança do produto assim exigirem.
Assinale a alternativa que contém a sequência correta.
I. Os cátions apresentam o número de prótons menor que o número de elétrons.
II. Íon é uma espécie química que apresenta o número de prótons igual do número de elétrons.
III. Os cátions se formam quando um átomo perde um ou mais elétrons, resultando num sistema eletricamente positivo.
IV. Os ânions se formam quando um átomo ganha ou recebe um ou mais elétrons, resultando num sistema eletricamente negativo.
É INCORRETO o que se afirma apenas em
Considere a seguinte representação de um elemento químico:

É correto afirmar que o número
Limnologia é o estudo das águas continentais. Com relação a essa ciência, julgue o item a seguir.
O fósforo pode ser encontrado em diversas formas na água, sendo a análise da concentração de ortofosfato suficiente para determinar o potencial de eutrofização.
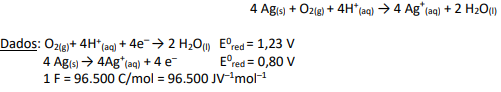
O valor da variação de energia livre, ∆G0 e a espontaneidade da reação é:
(CH3)3CBr + OH– → (CH3)3COH + Br–
Considerando os dados apresentados, a lei de velocidade para a reação é:
I. A velocidade de uma reação depende da concentração, mas a constante de velocidade não depende dela.
II. Quanto mais baixa for a energia de ativação, mais lenta a reação.
III. Se a velocidade de aparecimento de O2(g), 2 O3(g) → 3 O2(g), é 9 x 10–4 mol/L em determinado instante, a velocidade de desaparecimento do O3(g) é 18 x 10–4 mol/L.
Está correto o que se afirma em
I. Na reação química As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO, o nitrogênio sofre redução.
II. Na reação Cl2(g) + NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l), o cloro sofre, ao mesmo tempo, oxidação e redução, tratando-se, nesse caso, de uma reação de auto-oxirredução.
III. Na equação química MnO4- + Fe2+(aq) + H+ (aq) → Mn2+(aq) + H2O + Fe3+(aq), a soma dos menores valores inteiros dos coeficientes estequiométricos é 24.
Está correto o que se afirma em
I. Na eletrólise do sulfato de sódio, a água é mais facilmente oxidada no ânodo do que o SO4- e no catodo as moléculas de água são reduzidas mais facilmente que os íons sódio.
II. Na eletrólise do cloreto de sódio fundido, pode-se obter Cl2(g) no ânodo.
III. Na eletrólise de uma solução aquosa de NaF, o F– será reduzido.
Está correto o que se afirma em
Fe2+(aq) + 2 e– → Fe(s) Eo = – 0,44 V
Zn2+(aq) + 2 e– → Zn(s) Eo = – 0,76 V
Com base nos dados de potencial-padrão de redução das semirreações, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O zinco é mais facilmente oxidado e serve como ânodo.
( ) O ferro funciona como cátodo.
( ) O potencial desta pilha é 1,2 V.
( ) O ∆Eo < 0 caracteriza o funcionamento espontâneo da pilha.
A sequência está correta em