Questões de Concurso Sobre química
Foram encontradas 14.402 questões
t MnO2 + u HCl → v MnCl2 + x H2O + z Cl2
Os valores de t, u, v, x e z que correspondem ao balanceamento da equação são, respectivamente,
 2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
2N2 (g) + O2(g)
Considere as seguintes afirmações.
I. Na ausência de catalisadores a equação cinética depende da estequiometria dos reagentes.
II. Na presença de platina a velocidade da reação fica inalterada.
III. A reação, na presença de platina, ocorre inicialmente por um processo de adsorção ao metal.
Está correto o que se afirma APENAS em
CaCO3(s)
 CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
O deslocamento do equilíbrio no sentido dos produtos é mais favorecido com
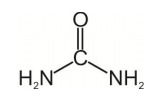
A retenção de umidade na pele pode ser atribuída a interações do nitrogênio presente na ureia com a água por interações intermoleculares do tipo
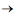 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
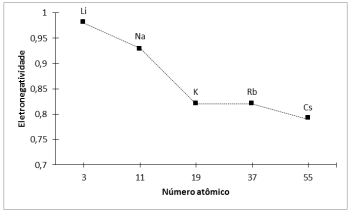
De acordo com os dados apresentados, o metal alcalino que estabelecerá com o flúor a ligação química de maior caráter iônico será o
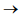 2NO2
(g)
2NO2
(g)  H1
2N2O(g) + 3O2
(g)
H1
2N2O(g) + 3O2
(g)  4NO2
(g)
4NO2
(g)  H2
H2 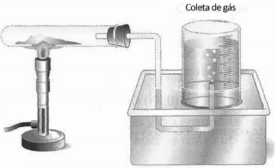
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
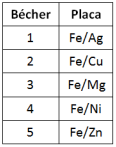
Considere a tabela a seguir.
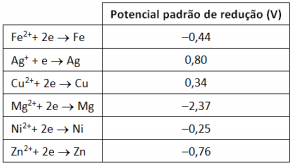
Após o mesmo tempo de observação, o bécher em que se verifica a menor taxa de corrosão da placa de ferro é o
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
