Questões de Concurso Sobre química
Foram encontradas 14.919 questões
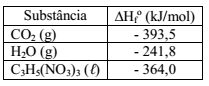
A nitroglicerina é um explosivo poderoso que ao detonar forma quatro gases diferentes, conforme apresentado na reação não balanceada:
C3H5(NO3)3 (ℓ) → N2 (g) + O2 (g) + CO2 (g) + H2O (g)
Determine a energia liberada (kJ/mol) na detonação de 100 g de nitroglicerina, a partir da tabela abaixo e considerando que H = 1u; C = 12u; N = 14u; O = 16u:
85,5 g de sacarose (C12H22O11) são dissolvidos em 180 g de água. A fração molar da solução é igual a
Dados: H = 1u; C = 12 u; O = 16 u.
Recentemente ocorreu um sério desastre ambiental onde o rompimento de uma barragem com rejeitos da extração de minério de ferro inundou um distrito na cidade de Mariana, MG. O ferro apresenta 4 isótopos naturais. Eles estão apresentados na tabela abaixo assim como seus números de massa e abundâncias naturais.
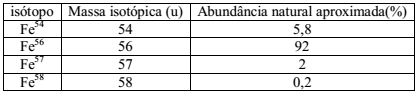
De acordo com a tabela acima, a massa atômica média do ferro é igual a:
O carbonato de cálcio reage com o ácido bromídrico produzindo brometo de cálcio de acordo com a reação apresentada abaixo:
CaCO3 + HBr → CaBr2 + H2O + CO2
Indique a massa, em gramas, de brometo de cálcio obtida quando 20 g de carbonato reagem com 15 g de ácido bromídrico. Considere que Ca = 40 u; C = 12 u; O = 16 u; H = 1u e Br = 80u.
Atenção: A questão refere-se ao conteúdo de Conhecimentos em Gás Natural.
O Gás Natural Liquefeito (GNL) é basicamente gás natural que, após purificado, é condensado ao estado líquido por meio da
redução da sua temperatura a −163 °C. A vantagem de se liquefazer o gás natural é
Atenção: A questão refere-se ao conteúdo de Conhecimentos em Gás Natural.
O gás natural de uma determinada tubulação tem o Limite Inferior de Explosividade de aproximadamente 5% em volume e o
Limite Superior de Explosividade de aproximadamente 15% em volume. Isso significa que, se essa tubulação se romper e
provocar uma mistura entre gás natural e ar, em que o gás natural esteja a uma concentração de 20% em volume
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
A reação 2HI(g) 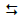 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
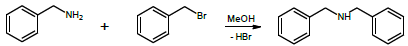
A cinética da reação de brometo de benzila com benzilamina foi estudada por Ravi e colaboradores. Os autores verificaram que a reação é de primeira ordem com respeito a cada reagente.
A reação é esquematizada a seguir:
Em um experimento conduzido a 298 K, com excesso de benzilamina, o perfil de decaimento do brometo de benzila foi registrado, sendo apresentado na figura a seguir.
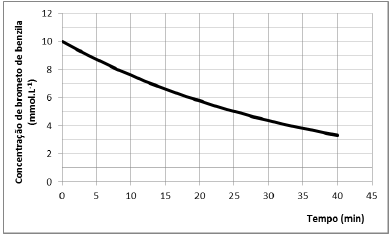
Nessas condições, o tempo (em minutos) em que a concentração
de brometo de benzila terá sido reduzida à 1/8 da concentração
inicial é de
 , é possível esperar
, é possível esperarNa determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
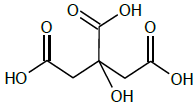
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.
 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233“Após a descoberta do elétron, não seria possível ainda conceber um átomo como uma esfera rígida, indivisível, mas como uma esfera ou nuvem de carga positiva, na qual os elétrons estariam embebidos, uniformemente distribuídos.”
Esse conceito de átomo é atribuído a