Questões de Concurso Sobre química
Foram encontradas 13.580 questões
I – medição rigorosa de volumes de líquidos
II–mediçãodevolumesdesoluções
III – medição menos rigorosa de volumes de líquidos
As utilizações descritas se relacionam principalmente com os seguintesinstrumentosrespectivamente:
Omoldeseumonômeroé:
I- Zn+2HCl→ H2+ZnCl2
II- 2NaBr+Cl2 → 2NaCl+Br2
III- Ca+FeSO4 → Fe+CaSO4
IV- Al+3HCl→ 3/2H2+AlCl3
V- 2KF+Cl2 → 2KCl+F2
Em função da reatividade dos metais e dos halogênios, podemosafirmarqueocorremasreações:
I- metal alcalino-terroso
II- em sais pode ter número de oxidação-1
III- em sais pode ter número de oxidação+7
IV- sua configuração eletrônica termina com s1
Os seguintes elementos correspondem respectivamente às informações I a IV:
Na proteção com metal de sacrifício, o material a ser protegido é conectado como ânodo de uma célula galvânica, sendo o cátodo um metal mais ativo que se consome à medida que protege o material.
Há casos benéficos de corrosão, como a oxidação de aços inoxidáveis, que produz uma camada protetora de óxido de cromo, e a proteção do material de alumínio, com a formação de óxido de alumínio.
Considerando os potenciais de oxidação mostrados a seguir, é correto afirmar que a limpeza de aço inoxidável com cloro pode ser recomendada por impedir a corrosão devido ao menor potencial de oxidação (E) do ferro (Fe) em relação ao cloro
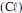 .
.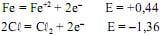
A principal diferença entre os processos de polimerização de etileno sob alta pressão e sob baixa pressão está na utilização, por este último, de um sistema catalítico.
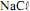 operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de 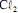 . Considerando que a massa molar do
. Considerando que a massa molar do 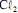 seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.Na eletrólise da solução aquosa de
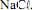 a formação do
a formação do 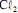 ocorre no ânodo da célula.
ocorre no ânodo da célula.  operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de
operando com uma corrente constante de 100,0 A e com rendimento de 100% para a formação de  . Considerando que a massa molar do
. Considerando que a massa molar do  seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.
seja igual a 70,9 g/mol e que a constante de Faraday seja igual a 96.500 C/mol, julgue o próximo item.O tempo necessário para a formação de 709 g de
 , a partir da eletrólise da solução aquosa de
, a partir da eletrólise da solução aquosa de  , é superior a 2 h.
, é superior a 2 h.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
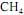 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 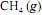 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Se o consumo mensal de energia elétrica da referida empresa for de 1,0 × 1012 J, a combustão do
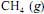 , sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de
, sob pressão constante de 1 bar e a 25 ºC, produzirá mais de 40 toneladas de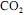 para suprir as necessidades mensais de energia da empresa.
para suprir as necessidades mensais de energia da empresa.  , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
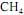 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 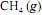 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do
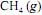 deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.
deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.