Questões de Concurso Sobre química
Foram encontradas 14.919 questões
I- metal alcalino-terroso
II- em sais pode ter número de oxidação-1
III- em sais pode ter número de oxidação+7
IV- sua configuração eletrônica termina com s1
Os seguintes elementos correspondem respectivamente às informações I a IV:
1. É responsável por manter a temperatura média do planeta próxima dos 15º C.
2. A emissão dos chamados gases estufa aumenta a quantidade de energia, que é mantida na atmosfera devido à absorção do calor refletido ou emitido pela superfície do planeta, provocando a elevação da temperatura da superfície.
3. Ocorre quando os gases nitrogenados e/ou sulfonados, produzidos por uma série de atividades da sociedade moderna, reagem com o vapor de água na atmosfera, produzindo ácidos (nítrico e/ou sulfúrico).
4. O Dióxido de carbono (um dos gases estufa) é o principal composto resultante da combustão completa de combustíveis fósseis e de outros materiais combustíveis que contenham carbono, além de ser gerado no processo de respiração aeróbia dos seres vivos, que utilizam o oxigênio para poder liberar a energia presente nos alimentos ingeridos.
Está CORRETO o que se afirma em
(02) Monóxido de Carbono (CO), composto gerado nos processos de combustão incompleta de combustíveis fósseis e outros materiais que contenham carbono em sua composição.
(04) Os hidrocarbonetos são resultantes da queima incompleta dos combustíveis bem como da evaporação desses combustíveis e de outros materiais, como os solventes orgânicos.
(06) O calor é uma forma de poluição atmosférica por energia que ocorre, principalmente, devido à emissão de gases à alta temperatura para o meio ambiente, gases esses que são liberados, em sua maioria, nos processos de combustão.
(08) As principais fontes de geração de Amônia são as indústrias químicas e de fertilizantes, principalmente, aquelas à base de nitrogênio, além dos processos biogênicos naturais que ocorrem na água ou no solo.
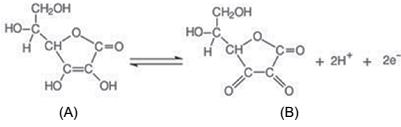
Baseado nestas informações, é correto afirmar que:
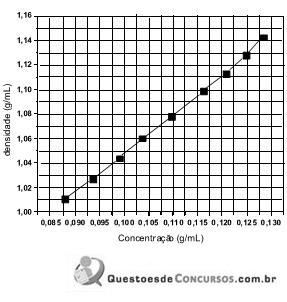
A amostra de leite da solução analisada apresentou um valor de densidade de 1,070 g/mL. Sabendo-se que a fórmula química da lactose é C12H22O11, a concentração da lactose (em mol/L) na amostra é de:
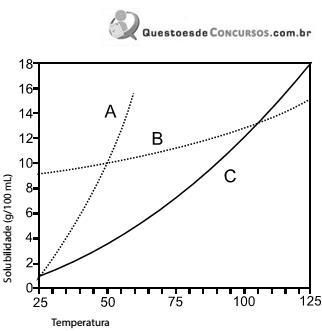
Baseado nestas informações é correto afirmar que:
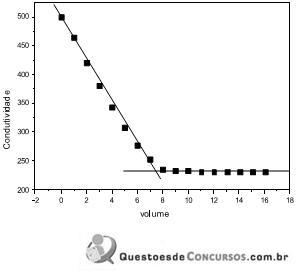
Atente-se que para a primeira reta, a equação obtida foi: y = -23,291 x + 456,64 e para a segunda reta, a equação obtida foi: 231,8.
Baseado nessas informações, é correto afirmar que o volume do ácido necessário para alcançar o ponto de equivalência e a concentração do ácido é respectivamente:
CH3 -CH(CH3 )- CH2 -CH2 -OH,
CH3 –CH2 -CH(CH3 ) - CHO,
CH3 -CH2 -CH2 -NH-CH3
Indicadores ácido-base Cor e pH
fenolftaleína Incolor em pH ≤ 8,3
Rosa-claro em pH entre 8,3 e 10,0
Vermelho em pH ≥ 10,0
Azul de bromotimol amarelo em pH ≤ 6
azul em pH ≥ 7,6
verde em pH entre 6,0 e 7,6
Alaranjado de metila vermelho em pH ≤ 3,1
alaranjado em pH entre 3,1 e 4,4
amarelo em pH ≥ 4,4
A amostra da água da chuva em contato com a solução de:
(1) 40 mL de uma solução de NaOH foi totalmente neutralizada com 16 mL de uma solução de HCl.
(2) Depois, 55 mL de NaOH foram adicionados a uma quantidade de matéria de 0,046 mols de ácido acético.
(3) O excesso de NaOH da etapa 2 foi titulada com uma solução de HCl e foram gastos 8,25 mL do ácido até o ponto de equivalência.
Com base nessas anotações, o volume de NaOH necessário para neutralizar 0,046 mols de CH3COOH é de:
Baseado nessas informações, é INCORRETO afirmar que:

Levando em consideração os algarismos significativos, o volume correto lido da proveta é:
Dados que as concentrações iniciais do CH 3 COOH CH3COO– são iguais e valem 0,125 mol/L, o pKa = 4,75, e que log 0,98 = -0,007, pode-se afirmar que: