Questões de Concurso Sobre química
Foram encontradas 14.919 questões


O gráfico a seguir apresenta a entalpia de combustão, em certa temperatura, para o etano, o propano, o butano, o pentano e o hexano.

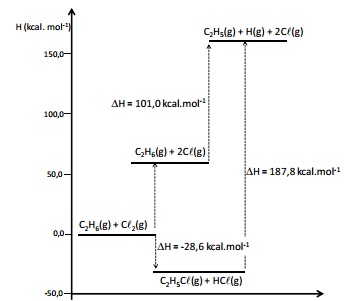
A energia de dissociação de ligação é uma medida da força da ligação química. É definida como a mudança de entalpia padrão observada na quebra homolítica de uma ligação a 0 K. A inclusão de correções térmicas leva os valores de energia de dissociação à entalpia padrão de dissociação, definidos a 298 K.
O diagrama de energia a seguir apresenta as variações de entalpia, a 298 K, para diversos processos.
Nesta avaliação, diversos experimentos foram conduzidos, modificando alguns parâmetros iniciais como temperatura, concentração inicial do ácido e estado de agregação do zinco metálico.
Assinale a opção que apresenta um perfil de volume de H2 em função do tempo esperado para um par de experimentos, variando entre eles apenas um dos parâmetros.
Assinale a opção que representa a relação entre o número de partículas por unidade de volume (N/V) e as coordenadas volume (V) ou pressão/temperatura (P/T) dos sistemas gasosos.
A acidez titulável é expressa em porcentagem ( (massa/volume ) de ácido lático, representado pela fórmula estrutural a seguir:
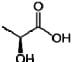
Em um ensaio, uma alíquota de 10 mL de amostra de leite e foi colocada em um erlenmeyer e adicionou-se duas gotas de fenolftaleína. A titulação da amostra consumiu 1,68mL-1 de solução de NaOH 0,100 mol.L -1 .
A acidez do leite na amostra, expressa em porcentagem, (massa/volume) é de
Dados: Massas molares: H= 1 g.mol –1 ; C= 12 g.mol –1 ; O= 16 g.mol –1 .