Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Os raios ultravioletas degradam os polímeros, tornando-os quebradiços.
Os plásticos não resistem aos álcalis.
Os plásticos resistem aos ácidos minerais diluídos.
Em contato com o solo, os plásticos sofrem degradação, especialmente em solos úmidos ou ácidos.
Os plásticos produzidos por polímeros com anel benzênico são resistentes à degradação em caso de ataque de solventes benzênicos.
As cargas podem ser classificadas como de origem orgânica e de origem inorgânica.
A adição de carga, dentro de um limite de incorporação, aumenta a tenacidade do polímero.
A fibra de vidro é uma carga adicionada ao polímero para que se reduza a rigidez do polímero.
As cargas podem ser adicionadas ao polímero para que se diminua o custo final do produto.
O fato de se adicionar grafite pulverizado como carga ao polímero aumenta a resistividade do material.
A reciclagem mecânica está associada à redução de tamanho e modificação do formato de resíduos plásticos e à remoção de contaminantes. Durante esse processo de reciclagem, a estrutura química básica dos resíduos plásticos permanece inalterada.
Reciclagem energética consiste na recuperação de energia por meio de tratamento químico primário de resíduos plásticos. A quebra das cadeias poliméricas resulta em materiais de elevado poder calorífico, que é empregado como combustível para fins de geração de energia.
Reciclagem química se baseia no uso de processos químicos com a finalidade de quebrar as cadeias poliméricas, convertendo-as em compostos químicos básicos como monômeros e misturas de hidrocarbonetos.
Em sistemas ternários, o adesivo, considerado um elemento de ligação, deve apresentar, como características desejáveis, a homogeneidade e a boa capacidade de molhar a superfície das peças que se pretenda juntar.
Em extrusoras com geometrias similares, operando com tempos de residência constantes, a relação entre capacidade de processamento e volume livre é expressa por
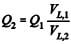 , em que Q1 e Q2 correspondem, respectivamente, à vazão mássica das extrusoras de menor e maior capacidade, e VL,1 e VL,2 são os volumes livres dos elementos de rosca, respectivamente, das extrusoras de menor e de maior capacidade.
, em que Q1 e Q2 correspondem, respectivamente, à vazão mássica das extrusoras de menor e maior capacidade, e VL,1 e VL,2 são os volumes livres dos elementos de rosca, respectivamente, das extrusoras de menor e de maior capacidade. Julgue o item a seguir, relativos ao tempo de residência e ao aumento de escala em processos de extrusão de materiais plásticos.
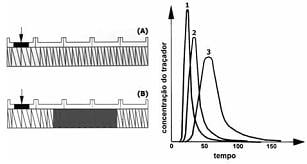
A curva de distribuição de tempo de residência identificada pelo algarismo 1 no gráfico mostrado abaixo resulta do elemento de rosca representado pela letra A.
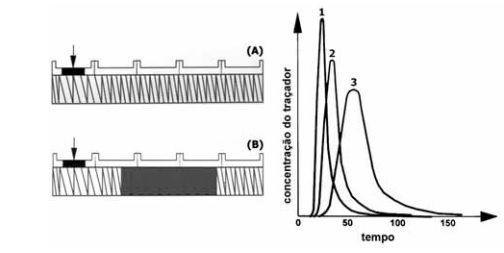
A introdução de blocos de amassamento aumenta o tempo de residência do material plástico na zona de processamento da extrusora.
A temperatura de transição vítrea de plásticos provenientes de copolímeros aleatórios independe da composição das cadeias poliméricas, com valores em uma faixa intermediária, compreendida entre as temperaturas de transição vítrea dos seus respectivos homopolímeros.
Valores baixos de massa molar média de materiais plásticos provenientes de polímeros orgânicos estão relacionados a valores altos de temperatura de transição vítrea.
Nos materiais poliméricos à base de copolímeros, como, por exemplo, polietilenos e polipropilenos semicristalinos, imperfeições nas cadeias poliméricas resultantes da inserção de uma segunda espécie monomérica conduzem a uma diminuição na temperatura de fusão desses materiais.