Questões de Concurso Sobre química
Foram encontradas 14.243 questões
A energia necessária para levar o gelo até a temperatura de fusão e a energia necessária para fundir o gelo, são, em J, respectivamente,
Considere
cgelo = 2,2 J/g K
LF =330 J/g
I - É função do revestimento impedir a mistura do material da alma metálica com o metal de solda.
II - É função do revestimento a remoção dos elementos de liga do metal de solda.
III - É função do revestimento o isolamento mecânico da alma metálica.
É correto APENAS o que se afirma em

Qual é, em J, a energia retirada para congelar os 100 g de água?
Dados
Lfusão = 336 J/g
cágua = 4,2 J/g.° C
H2 + 1/2 O2 → H2O
Nesse processo, quantos mols de O2 são necessários para produzir 10 mols de H2 O?
Esse fenômeno é denominado
Na reação de oxirredução representada pela equação não balanceada acima, o número de oxidação médio do.

Com respeito a essa propriedade, o(a)
Com o exclusivo objetivo de neutralizar o ácido, o procedimento correto deve ser o de jogar no asfalto solução aquosa de
Utilize as informações contidas na Tabela de potenciais de redução abaixo para responder a questão.
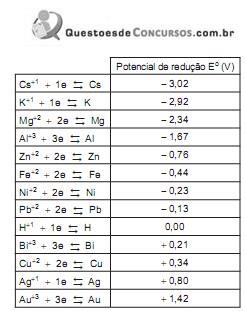
Considere a pilha abaixo representada pela seguinte equação:

Considerando o valor da constante de Faraday igual a 96.500 C, e que essa é a quantidade de carga elétrica de 1 mol de elétrons, qual é a quantidade máxima, em gramas, de sódio metálico que se forma, com a carga elétrica de 386.000 C, na eletrólise ígnea do NaCl?
Dado
M(Na) = 23 g/mol
HC2 H3 O2(aq) + H2 O(l)
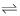 H3 O+ (aq) + C2 H3 O2 - (aq)
H3 O+ (aq) + C2 H3 O2 - (aq) Com o objetivo de estudar a variação do valor do pH (capacidade freadora ou de tamponamento) dessa solução, um técnico fez experiências adicionando a três alíquotas da solução um volume específico das seguintes substâncias: (i) água pura, (ii) uma solução aquosa de base forte e (iii) uma solução aquosa de ácido forte.
Considerando esse equilíbrio e as condições externas que podem perturbá-lo até que se atinja um novo equilíbrio, constata-se que na adição de 10,0 mL de
1o ) Transfira uma solução padrão de permanganato de potássio 0,5000 mol/L para uma bureta limpa e seca.
2o ) Pipete 25,00 mL de amostra de água oxigenada comercial para um balão volumétrico de 250,00 mL, acrescente água destilada até o traço de referência e faça a homogeneização. Dessa solução, pipete uma alíquota de 25,00 mL para um frasco Erlenmeyer, acrescente ±100 mL de água destilada e 5 mL de ácido sulfúrico concentrado.
3o ) Titule o H2 O2 contido na alíquota com a solução padrão de permanganato de potássio até coloração levemente violeta (1o excesso de KMnO4 ).
A reação que ocorre na titulação é:
2 MnO4 - (aq) + 5 H2 O2(aq) + 6 H+ (aq) → 2 Mn2+ (aq) + 5 O2(g) + 8 H2 O(l)
Seguindo esse roteiro, o volume de solução de permanganato de potássio gasto na titulação da alíquota no frasco Erlenmeyer foi igual a 30,40 mL.
Com base nos resultados da análise, o técnico constatou que a porcentagem massa por volume (g H2 O2 /100 mL água oxigenada) na amostra original é igual a
Dado M(H2O2) = 34,00 g/mol
KHC8 H4 O4(aq) + NaOH(aq) → KNaC8 H4 O4(aq) + H2 O(l)
A solução aquosa de NaOH a ser padronizada e a água usada na preparação do padrão primário foram tratadas para ficar isentas de CO2 dissolvido. Em pesa-filtro de forma baixa pesaram-se 7,4245 g de biftalato de potássio. A essa massa foi adicionada água suficiente para a sua dissolução total de forma que o padrão primário fosse transferido quantitativamente para balão volumétrico de 250,00 mL, onde o volume foi ajustado até o traço de referência pela adição de água. Uma alíquota de 25,00 mL dessa solução foi titulada com a solução de NaOH, usando a fenolftaleína como indicador do ponto final.
Sendo o volume da solução aquosa de NaOH gasto na titulação, até a mudança de cor da fenolftaleína para rosa claro, igual a 22,78 mL, a concentração em quantidade de matéria (mol/L) da solução de NaOH é
Dado M(KHC8H4O4) = 204,23 g/mol
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
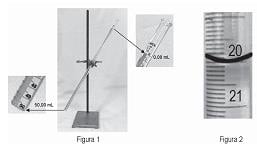
Acrescentou água até a marcação indicada na Figura 2, fez a leitura para chegar ao volume contido e constatou que o valor do erro relativo percentual na medida do volume contido, levando em conta a leitura a partir do menisco inferior, é, aproximadamente,
Esse processo é conhecido como
Soluções Cor da solução na presença Cor da solução na presença Cor da solução na presença
azul de bromotimol de alaranjado de metila de fenolftaleína
1 amarela vermelha —
2 azul amarela —
3 amarela amarela incolor
4 verde — incolor
De acordo com os resultados, o técnico concluiu que as soluções 1, 2 , 3 e 4 eram, respectivamente,
Dados
cores dos indicadores em diferentes faixas de pH (valores aproximados).
Azul de bromotimol Alaranjado de metila Fenolftaleína
pH < 6,0 – cor amarela pH ≤ 3,1 – cor vermelha pH < 8,2 – incolor
pH entre 6,0 e 7,6 – cor verde pH entre 3,2 e 4,4 – cor laranja pH entre 8,2 e 10,0 – cor rosa claro
pH > 7,6 – cor azul pH > 4,4 cor amarela pH > 10 cor rosa intenso