Questões de Concurso Sobre química
Foram encontradas 13.580 questões

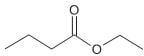
Segundo as regras da IUPAC, sua nomenclatura é
Sobre corrosão, considere as afirmativas a seguir.
I - A água do mar é considerada um meio corrosivo, e o solo é considerado um meio inerte, não corrosivo.
II - A corrosão do ferro é um processo espontâneo e representa a tendência de formação de um produto mais estável.
III - A proteção catódica é uma escolha adequada para revestir superfícies metálicas passíveis de corrosão.
Está correto APENAS o que se afirma em
I - Interpolar o sinal do analito medido diretamente na amostra, numa curva de calibração feita com padrões aquosos de Cu 2+.
II - Extrair totalmente os íons Cu 2+ em coluna de troca iônica e, depois, eluir todo o analito em meio aquoso para separá-lo dos componentes da matriz e usar interpolação do sinal do analito numa curva de calibração com padrões aquosos de Cu 2+.
III - Separar o íon Cu 2+ em clorofórmio (extração líquido- líquido) e interpolar o sinal analítico numa curva de calibração feita com padrões de Cu 2+ preparados em clorofórmio.
Proporcionariam um resultado exato APENAS as estratégias propostas em
Dentre os eletrodos que devem ser usados como referência, NÃO se inclui o eletrodo
O valor mais aproximado para o Rf da substância mais polar é
A solução utilizada pelo técnico foi
2A(g)+ 3B(g) → A2 B 3(g)
De um conjunto de experimentos foram coletados dados e estes, organizados na seguinte tabela:

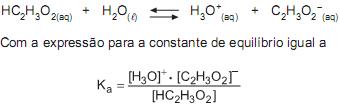
Princípio de Le Chatelier: “Se um sistema em equilíbrio é submetido a uma perturbação, o sistema se ajusta de modo a contrapor os efeitos da perturbação e alcançar uma nova situação de equilíbrio”.
Com base nesse princípio, na expressão da constante Ka, e considerando temperatura e força iônica constantes, após a adição de 1 mL de solução aquosa de NaOH 1 mol/L à solução contendo acetato de sódio e ácido acético, uma nova situação de equilíbrio seria alcançada após o(a)
H 2(g)+ I 2(g) ⇆ 2HI (g)
O equilíbrio, nessa temperatura, foi atingido com as concentrações de H 2(g) , I 2(g)e HI(g)iguais a 0,0040 mol/L, 0,0040 mol/L e 0,028 mol/L, respectivamente.
A constante de equilíbrio, nessa temperatura, em função das concentrações em quantidade de matéria (mol/L) é igual a
Na2 SO4(aq)+ BaCl 2(aq)→ BaSO 4(s)+ 2NaCl (aq)
A quantidade máxima de sulfato de bário que se forma é, aproximadamente, de
A porcentagem de CaCO3 presente nesse calcário é
I - N+ O2(g) →2 NO(g)- 43,0 kcal
II - 2P(s)+ 5Cl2(g) → 2PCl5(g)+ 190,8 kcal
III - 2Fe(s) + O 2(g) → 2 FeO(s) ΔH = - 64,04 kcal
São reações exotérmicas
Qual a classificação dos hidrocarbonetos que apresentam cadeia aberta e saturada, além de possuírem apenas ligações simples?
I - O átomo é constituído por um núcleo muito pequeno com carga neutra, contendo prótons e elétrons, enquanto os nêutrons orbitam em torno dele, na chamada neutrosfera.
II - O átomo é uma estrutura contínua, na qual, prótons e elétrons estariam misturados continuamente como num bolo recheado de passas.
III - A massa do átomo está praticamente concentrada no núcleo, uma vez que os elétrons são muito mais leves que os prótons e os nêutrons.
Está correto APENAS o que se afirma em
Qual o coeficiente de solubilidade (CS) dessa solução?
Sabendo-se que um mol desse ácido tem 98 g, qual a concentração em mol/L dessa solução?
Dispersões são classificadas de acordo com o tamanho médio das partículas da substância dispersa, em ordem crescente, da seguinte forma: