Questões de Concurso Sobre química
Foram encontradas 13.580 questões

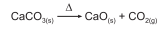
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é
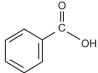
A respeito do ácido benzoico, sabe-se que
Considere a hipótese de reação, unicamente na direção do produto, entre 5 mol de nitrogênio gasoso e quantidade suficiente de hidrogênio gasoso para o consumo total do N2 e formação de gás amoníaco, conforme a equação a seguir.
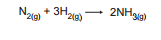
O volume máximo de NH3(g) , em litros, a ser obtido na CNTP é
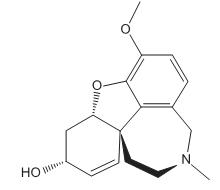
A galantamina, cuja representação pode ser visualizada acima, é uma substância usada no tratamento do Mal de Alzheimer. Sobre a estrutura dessa substância, afirma-se corretamente que

A charge faz uma critica às exigências de controle de qualidade para a certificação em produtos. Nessa perspectiva, considere que a massa desse projétil é 1,5 g. Logo, a massa de prata presente, em gramas, é aproximadamente

Trata-se de uma reação de oxirredução, e nela
As supressoras do apetite, como o femproporex, representado na figura abaixo, geralmente atuam no sistema nervoso central.
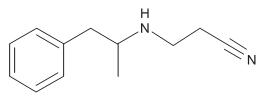
Com relação ao femproporex, a sua estrutura molecular apresenta

Considere um recipiente para metais que contém somente latas de ferro e latas de alumínio. O método apropriado para separar, nesse recipiente, um metal do outro é o processo envolvendo
A partir dessas informações e assumindo que a acidez do hidrolisado foi decorrente exclusivamente da dissociação do ácido sulfúrico, qual foi a quantidade de hidróxido de cálcio utilizada na neutralização?
Dado: Composição química média do Al 2024-O (Cu = 4,5%; Si = 0,5% ; Fe = 0,5% ; Mn = 0,5% ; Mg = 1,5% ; Zn = 0,25% ; Cr = 0,10%)
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir
I - Entre uma chapa metálica e um anel de vedação de borracha, que se degradou com o uso, formou- se uma região com umidade e pouca aeração, ocorrendo corrosão a partir de uma pilha galvânica entre a região aerada da chapa (catódica) e a não aerada (anódica).
II - Em uma peça metálica, formou-se um depósito isolado de restos de pintura sobre uma das superfícies expostas a uma solução salina, ocorrendo a corrosão em função da diferença de potenciais entre a região sob o depósito de pintura e a região sem depósito.
III - Uma cavidade, em formato de fenda longilínea, é perpendicular à superfície exposta a uma solução, sendo que a pilha galvânica veio a se formar entre a região oclusa da peça e a solução aquosa que se aloja no interior da fenda.
É(São) correta(s) a(s) situação(ões)
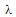 = 500 nm e caminho ótico = 20 mm. Sabendo-se que a absortividade molar desse soluto, em 500 nm, é 5,5 .103 L mol -1 cm-1 , a massa molecular do soluto, em g/mol, é
= 500 nm e caminho ótico = 20 mm. Sabendo-se que a absortividade molar desse soluto, em 500 nm, é 5,5 .103 L mol -1 cm-1 , a massa molecular do soluto, em g/mol, é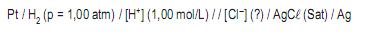
Para diferença de potencial de + 340 mV, determinada em um milivoltímetro eletrônico, a concentração aproximada de cloreto, na amostra de água, em mol/L, é

I – O gás hidrogênio é borbulhado continuamente sobre a superfície do eletrodo a uma pressão de 1,00 atm.
II – O potencial de redução do eletrodo padrão de hidrogênio, atribuído por convenção, é zero em qualquer temperatura.
III – O metal condutor (Pt) é reduzido pelo hidrogênio atômico, formando um depósito de platina finamente dividida (negro de platina).
IV – A reação do eletrodo de hidrogênio é irreversível, ocorrendo sempre no sentido da redução.
Estão corretas APENAS as afirmativas