Questões de Concurso Sobre química
Foram encontradas 13.586 questões
O propeno é muito utilizado, também, na produção do cumeno, por meio da alquilação Friedel-Crafts do benzeno catalisada por HF. A representação dessa reação é mostrada no esquema a seguir.

Com respeito às alquilações Friedel-Crafts e às espécies envolvidas nessas reações, julgue o item que se segue.
A fórmula molecular do cumeno é C9H12.
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
A adição de um gás inerte ao processo reativo de formação da
amônia — na mesma temperatura dos outros gases —
estabelecerá um novo equilíbrio químico que irá deslocar a
reação para o aumento da produção da amônia, em relação ao
equilíbrio anterior, antes da adição do gás inerte.
O LSD é uma droga ilícita semissintética derivada do ácido lisérgico, descoberto, em 1938, pelo químico suíço Albert Hofmann, como parte de um grande programa de pesquisa em busca de derivados de alcaloides ergolina que impedissem o sangramento excessivo após o parto. A rota biossintética do ácido lisérgico inicia-se com o aminoácido triptofano e passa por vários intermediários oriundos de metabolismo secundário como o aldeído chanoclavina e a agroclavina. Considerando essas informações e as estruturas moleculares mostradas acima, julgue o item subsequente.
A reação entre agroclavina, iodeto de metila e liga de zinco e cobre produz dois pares de diastereoisômeros.
O nitroprussiato de sódio — Na2[Fe(CN)5NO] — é um composto empregado como fonte de óxido nítrico — um potente vasodilatador — administrado por via intravenosa em pacientes em situação de emergência hipertensiva. O uso inadequado desse medicamento, que é sensível à luz e que produz cianeto em sua decomposição, pode causar morte acidental por déficit de oxigênio no organismo.
Com base nas informações apresentadas, julgue o próximo item.
Caso todos os ligantes desse composto fossem substituídos por
íons Br–
, o ânion gerado seria o hexabromoferrato(III), que
absorve radiação em comprimento de onda maior que o
absorvido pelo Na2[Fe(CN)5NO].
Para que ocorra o preenchimento do molde de injeção, uma condição necessária é que o polímero preencha perfeitamente a cavidade do molde. Para que isso ocorra, a viscosidade do polímero deve ser reduzida até um valor ideal, determinado pelas dimensões dos canais de injeção, espessura da peça e pressão disponível. Analise as afirmações abaixo:
I. A diminuição da viscosidade é obtida através do aumento no calor transmitido ao polímero diretamente pelas resistências de aquecimento do cilindro ou pelo trabalho de cisalhamento da rosca sobre o material durante a fase de dosagem.
II. O amumento da temperatura deve ser controlado, pois os polímeros possuem uma condutividade térmica muito alta, sendo bastante suscetíveis ao sobreaquecimento. Assim, se o material é exposto a temperaturas excessivas ou a um tempo de residência prolongado no cilindro, sofrerá degradação.
III. A degradação dos polímeros resultará no rompimento das moléculas, levando a uma redução do peso molecular e da viscosidade e também resultará em uma reticulação e aumento da viscosidade.
Qual(is) afirmativa(s) acima está(ão) INCORRETA(S)?
13Al2+ 11Na 10Ne+
Pode-se dizer que elas são:
Uma alíquota de 50,00 mL de NaCN é titulada com o HCl 0,1000 mol/L. Determine o pH após a adição de 10,00 mL de ácido, para a reação abaixo: (Dados log 4,13= 0,62)
CN-
+ H3O+  HCN + H2O
HCN + H2O
Um composto é formado de 92,32% de carbono e 7,68% de hidrogênio. Nas condições normais de temperatura e pressão (CNTP), 11,2 L de seu vapor pesam 39 g. A sua fórmula molecular é:
Dados: C=12 e H=1.
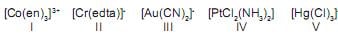
A única opção que apresenta os compostos de coordenação que têm o mesmo número de coordenação é:
Dados: en = etilenodiamina;
edta = etilenodiaminotetracetato
As fibras sintéticas são obtidas a partir de polímeros cujos monômeros ligam-se por reações de condensação, por isso, são chamados polímeros de condensação. O dracon, um exemplo de fibra sintética, é produzido pela esterificação do ácido tereftálico com etilenoglicol.
I:2NiS+3O2 → 2NiO+2SO2
II:NiO+C→ Ni+CO
Duas toneladas de um minério contendo NiS foram processadas,obtendo-se 293,5gramasdeNíquel metálico. O percentualaproximadodeNiSnominérioprocessadofoide:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol-1 e o valor da constante universal dos gases é 0,082 J.mol-1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:

