Questões de Concurso Sobre química
Foram encontradas 14.919 questões
A soma dos coeficientes da reação química acima, ajustados pelo método de oxirredução, é

Nessas condições, o valor da pressão de vapor do tolueno, em pascal, é
Até que temperatura deve ser resfriada, no cristalizador, a solução saturada?
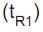 igual a 10,2 min, enquanto o tempo de retenção
igual a 10,2 min, enquanto o tempo de retenção 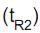 da substância “N” é 15,2 min.
da substância “N” é 15,2 min. A respeito desse procedimento de separação, afirma-se que a(o)
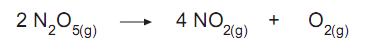
Dois experimentos foram feitos visando a obter informação sobre a cinética de reação. Os resultados das experiências estão no quadro abaixo.

A partir dos dados do quadro, conclui-se que a expressão da lei de velocidade de decomposição do
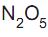 é
é
Analisando o esboço da tabela periódica e a posição de cada elemento nos espaços em branco e sabendo que há uma relação entre a posição do elemento e a distribuição dos seus elétrons em subníveis e níveis na camada de valência, está INCORRETO afirmar que os átomos dos elementos situados no
Com base na distribuição dos elementos na tabela, em grupos e períodos, pode-se prever e afirmar que a(o)
Considere as equações das seguintes reações que se encontram em condições de equilíbrio:
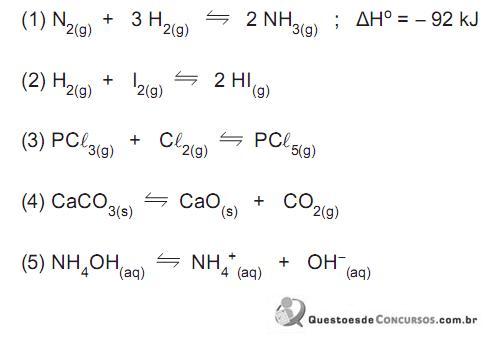
Sobre o deslocamento das reações de suas condições de equilíbrio por meio de ação externa, é INCORRETO afirmar que
A diferença de frequência (em Hz ou s-1 ) entre essas duas transições espectrais é
Comparando as características das chamas produzidas por essas duas misturas gasosas, afirma-se que

O complexo de Fe(II) com 1,10-fenantrolina tem seu máximo de absorção em 510 nm. Nesse comprimento de onda, foram obtidas as absorvâncias de quatro diferentes soluções padrões de Fe(II) preparadas em excesso de 1,10-fenantrolina (ver na tabela acima as absorvâncias já corrigidas pelo valor do branco).
A partir desses dados, conclui-se que

Assumindo que as condições para o comportamento previsto pela lei de Beer são obedecidas, o valor de absorvância medida para a solução, a 370 nm e usando uma cubeta de 1 cm de caminho óptico, é
Sobre esse eletrodo, analise as afirmativas a seguir.
I - O eletrodo de membrana de vidro é principalmente usado para medição de atividade do íon H+.
II - Para fazer medições quantitativas exatas, o eletrodo de membrana de vidro deve estar associado a eletrodos de referência.
III - Um sistema de medição com o eletrodo de membrana de vidro dispensa o uso de ponte salina.
IV - O potencial de assimetria em um eletrodo de membrana de vidro tem como uma das causas as diferenças entre as superfícies interna e externa da membrana.
Está correto APENAS o que se afirma em
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
II - Pelo fato de o valor do
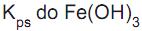 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido. III - O
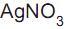 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz. IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em