Questões de Concurso Sobre química
Foram encontradas 13.691 questões
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
(1) CH3OH + H+ ↔ CH3OH2+ (rápida)
(2) CH3OH2 + → CH3OH + H+ (rápida)
(3) CH3OH2 + + Br- → CH3Br + H2O (lenta)
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo
de metila, d[CH3Br]/dt, por meio da citada reação.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.
Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Considere a curva de titulação:
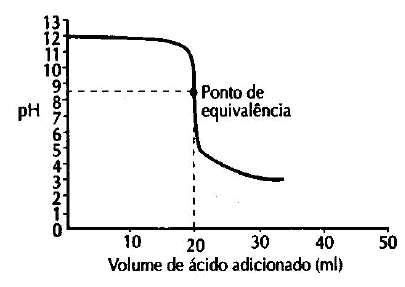
Analisando o gráfico, podemos considerar que o titulante e o titulado são, respectivamente:
A combustão do etanol produz calor por conta da variação de entalpia (ΔH) de reação, como indicado na equação a seguir:
C2H5OH (ℓ) + 3O2 (g) → 2CO2 (g) + 3H2O (g) ΔH = - 327 kcal
Sabendo-se que a densidade do etanol é 0,80 g mL-1 , e considerando-se combustão completa, pressão constante e um calor liberado de 9810 kJ, o volume, em litros, de etanol que reagiu foi
Dado
M (C2H5OH) = 46 g mol-1
Na seguinte figura, o recipiente da esquerda tem volume V, pressão P, temperatura T e contém 84 gramas de uma gás ideal. O recipiente da direita, também de volume V, contém 96 g de gás oxigênio puro, também ideal, na pressão P e temperatura T. Com base nessas informações, o gás contido no recipiente da esquerda é o
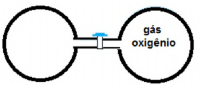
Um recipiente de volume igual a 1 m3 contém gás hélio com pressão parcial de 15 atm. Uma quantidade desse gás foi transferida, sem perda significativa, para um outro recipiente, inicialmente vazio e de volume igual a 5 m3 , até que a pressão parcial do hélio atingisse, nesse último, a pressão de 2 atm. As medições de pressão foram feitas quando o gás estava na temperatura de 298 K, e as condições foram ideais.
A massa de gás hélio, em g, que foi transferida do recipiente de menor volume para o de maior volume foi mais próximo de
Dados
M (H2 ) = 2 g mol-1 .
R = 0,082 atm L mol-1 K-1
1 m3
= 1000 L
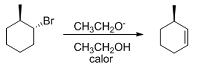
Sabendo que o produto principal do trans 1-bromo metilcicloexano,
ao se submeter este à desidrolagenção, é o 3-metilcicloexeno, de
acordo com a reação apresentada acima, assinale a opção correta.
Após uma reação química de queima, foram coletados, da câmara de combustão, os gases butano, oxigênio, dióxido de carbono, monóxido de carbono e água. Os gases foram acondicionados, sob temperatura e pressão constantes, em recipientes separados e deformáveis, cujos volumes aferidos estão especificados no quadro a seguir.
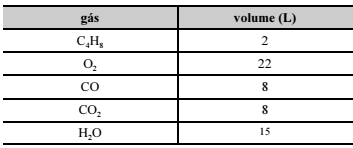
De acordo com a hipótese de Avogadro, é correto afirmar que o
número total de átomos é igual nos recipientes que contêm
A queima de gás metano ocorre conforme a equação abaixo:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(vapor)
Para a queima ao ar de 224 litros de metano, o volume total de ar utilizado na combustão e o volume total de gases e vapores ao final da combustão serão, respectivamente, de quantos litros?
