Questões de Concurso Sobre química
Foram encontradas 14.919 questões
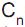 = 0,4 mol/L. Qual é a massa total, em gramas, de NaOH nessa solução?
= 0,4 mol/L. Qual é a massa total, em gramas, de NaOH nessa solução?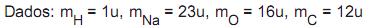
 = 180 g/100 g
= 180 g/100 g  . Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?
. Qual a massa de água, em gramas, presente numa solução saturada que contenha 36 g desse sal na mesma temperatura?A tabela a seguir fornece os dados cinéticos obtidos para a reação 2ICl(g) + H2(g) → I2(g) + 2 HCl(g)
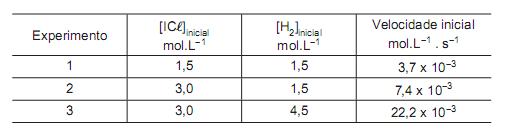
A partir dos dados experimentais obtidos, a expressão da velocidade para essa reação é
LAVOISIER, A.L. Tratado Elementar de Química. São Paulo: Madras, 2007, p. 162.
Já no final do séc. XVIII, Lavoisier utilizou uma linguagem química que nos é muito familiar atualmente. No trecho acima, ele descreve, por exemplo, a reação química entre o carbonato de cálcio (presente no mármore) e o ácido sulfúrico. Essa reação está corretamente representada em
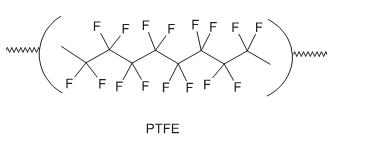
O monômero identificado na estrutura do PTFE é o
A reforma catalítica do heptano pode ser descrita, de maneira simplificada, pela seguinte equação química não balanceada:
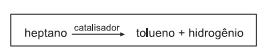
Utilizando-se estruturas químicas, essa reação fica corretamente descrita em
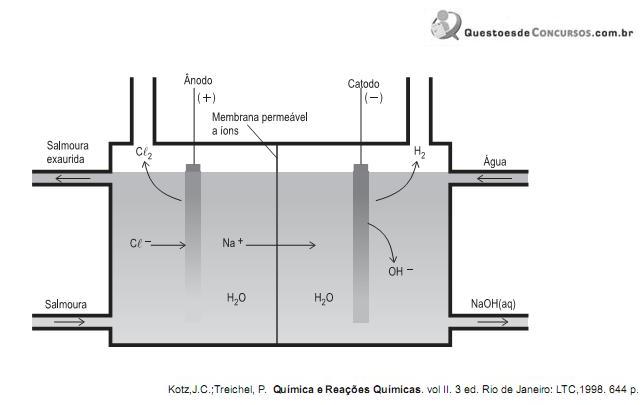
Com base nos conhecimentos sobre a eletrólise da salmoura, conclui-se que
As reações químicas que ocorrem em uma célula a combustível alcalina são representadas a seguir.
Ânodo: 2H2 (g) + 4OH− (aq) → 4H2O (l) + 4e−
Eletrólito: KOH (aq)
Catodo: O2 (g) + 4e− + 2H2O (l) 4OH− (aq)
Com base nesses dados sobre a célula a combustível alcalina, conclui-se que
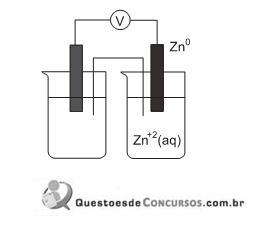

Para que essa pilha opere com a maior diferença de potencial possível (ΔEº), o outro eletrodo deverá ser o de
Considere a reação abaixo, onde íons permanganato reagem com ácido oxálico, em solução aquosa ácida, produzindo íons manganês II, dióxido de carbono e água.
2MnO4– (aq) + 5H2C2O4(aq) + 6H+(aq) → 2Mn+2(aq) + 8H2O(l) + 10CO2(g)
A partir do processo descrito, conclui-se que
Armazenando-se, por exemplo, uma solução de nitrato de cobre II – Cu(NO3)2 – em um tanque revestido internamente por estanho metálico, observam-se a contaminação dessa solução por íons de estanho e a deposição de cobre metálico no fundo do tanque. Esse fato ocorre porque o(s)
I – Em massa
II – Em solução
III – Em suspensão
Q – homogênea, sem uso de solvente.
R – homogênea, com uso de solvente
S – heterogênea, com o monômero e o iniciador insolúveis no meio dispersante (em geral, a água).
T – heterogênea, com o iniciador solúvel em água e o monômero apenas parcialmente solúvel.
A associação correta é:
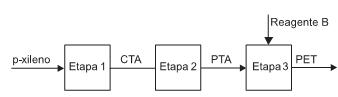
Nesse esquema,
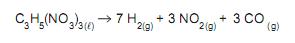
Essa reação química é identificada como