Questões de Concurso Sobre química
Foram encontradas 13.586 questões
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Na tentativa de estabelecer um peso para o oxigênio, descobriu-se que seu peso equivalente era 8, muito embora o oxigênio tivesse peso atômico 16, já que um volume de gás oxigênio pesava 16 vezes mais do que o mesmo volume de hidrogênio.
O peso equivalente do oxigênio era a metade do seu peso atômico porque
I. A concentração da solução é 0,02 mol l-1 . II. A concentração dos íon K+ e do íon Cl- é 0,02 mol l-1 . III. A concentração da solução é 0,60 g l-1 .
Assinale a alternativa que apresenta as asserções são verdadeiras.
I. Compostos metálicos são formados por arranjos de redes de núcleos de átomos de um determinado metal, formando uma parte interna positiva com os elétrons rodeando esse arranjo. II. O composto MgCl2 é um exemplo de ligação metálica. III. No composto orgânico ácido metanóico CH2O2, encontra-se as ligações do tipo covalente entre os compostos ligados ao carbono e ligação iônica entre um dos oxigênios e o hidrogênio. IV. O cloreto de vinila (cloroeteno) possui somente ligações covalentes.
Estão corretas as asserções:
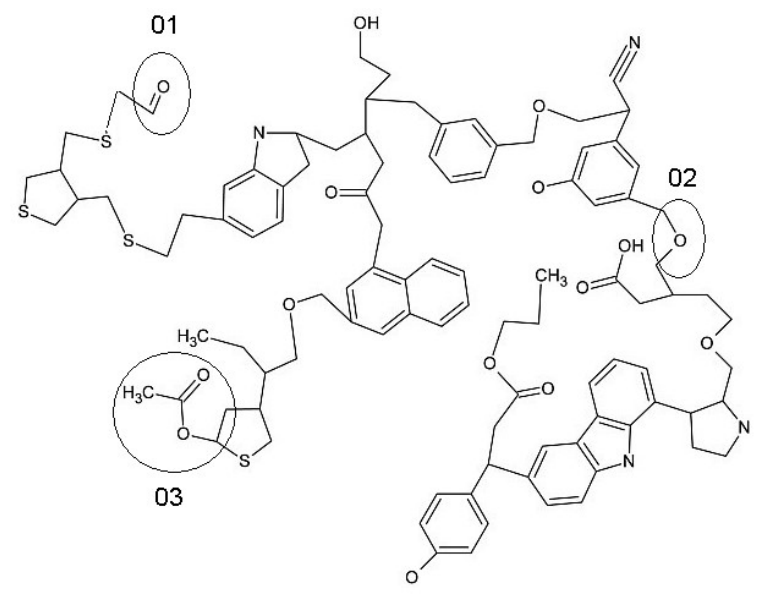 Fonte: https://novosinsolitos.blogspot.com/2011/11/materia-organica-complexa-e-encontrada.html
Fonte: https://novosinsolitos.blogspot.com/2011/11/materia-organica-complexa-e-encontrada.html As estruturas circuladas em 01, 02 e 03 na figura selecionam três funções orgânicas. Estas são, respectivamente,
Dados: log 2 = 0,30 e log 3 = 0,48
Reação 1: ΔH1 = +15,3 kJ/mol e ΔS1 =+30 J/K.mol Reação 2: ΔH2 = +1,8 kJ/mol e ΔS2 =-159 J/K.mol.
Escolha a alternativa que representa os valores de ΔG1 e ΔG2 em kJ/mol, respectivamente, e as previsões corretas de espontaneidade ou não espontaneidade da reação nessa temperatura:
Sendo dado Ka=1,8 x 10-4 , ao estimar o pH no ponto estequiométrico dessa titulação encontra-se:
As termobalanças são instrumentos que permitem a pesagem contínua de uma amostra em função da temperatura, ou seja, a medida em que ela é aquecida ou resfriada.
As curvas de variação de massa (em geral perda, mais raramente ganho de massa) em função da temperatura permitem tirar conclusões sobre a estabilidade térmica da amostra, sobre a composição e estabilidade dos compostos intermediários e sobre a composição de resíduo.
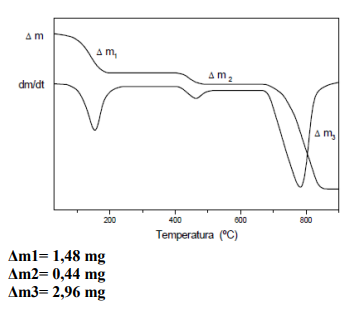
Sabendo que a curva de variação de massa acima é de uma amostra de CaMg(CO3)2 ou Ca(CO3) + Mg(CO3) de massa 10 mg, tendo a primeira perda de massa da amostra referente a águas de hidratação, que posteriormente ocorrem a formação dos resíduos óxido de magnésio e óxido de cálcio separadamente e respectivamente. Qual o percentual de óxido de magnésio formado?
“A plataforma do Instituto Nacional de Meteorologia (Inmet) que monitora as maiores temperaturas registradas no Brasil a cada 24h, mostra que cinco cidades do Tocantins estavam entre as 10 mais quentes do Brasil nesta quinta-feira (26/8)”.
(Disponível em: https://afnoticias.com.br/estado/um-sol-pra-cada-um-5-cidades-do-tocantins-ficam-no-top-10-das-mais-quentes-do-pais. Acessado em 28/09/2021)
Em um estado tão quente quanto o Tocantins, buscamos alternativas para amenizar o calor, como as piscinas. Porém, é necessário mantê-las limpas para uso. Durante o tratamento da água da piscina é utilizado o sulfato de alumínio Al2 (SO4)3.
A obtenção de sulfato de alumínio se dá pela reação do alumínio sólido (Al) com o ácido sulfúrico (H2SO4 ). Considerando os dois reagentes puros, nas condições normais de temperatura e pressão (CNTP), qual o volume, em litros, de gás formado durante a preparação de 114 g de Al₂ (SO₄ )₃?
Assinale a alternativa que apresenta a resposta correta:
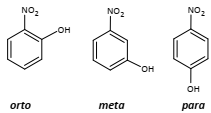
Apesar de serem isômeros entre si, eles possuem diferentes pontos de ebulição. Dentre eles, o composto de menor ponto de ebulição é o isômero
Considere a síntese em laboratório de uma molécula quiral que produziu uma mistura racêmica contendo 12,5% de cada estereoisômero.
A molécula sintetizada foi o