Questões de Concurso Sobre química
Foram encontradas 13.586 questões
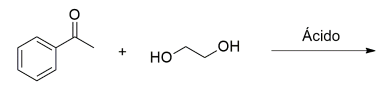
Qual é o produto dessa reação?
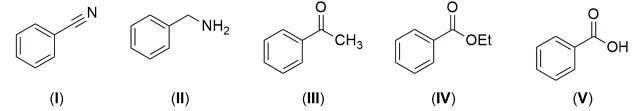
Qual dos compostos acima seria reduzido com NaBH4?
5 Fe2+(aq) + MnO4-(aq) + 8 H+(aq) → 5 Fe3+(aq) + Mn2+(aq) + 8 H2O(aq)
O ponto estequiométrico é atingido quando todo o Fe2+ reagiu, e a detecção é feita quando a cor característica da solução contendo íons MnO4- persiste. Para dissolver uma amostra de 202 mg de minério em ácido clorídrico, foram necessários 16,7 mL de uma solução 1,08 x 10-2 mol L-1 de KMnO4 para atingir o ponto estequiométrico. Qual é a porcentagem em massa de ferro na amostra?
Considere: densidade da água é igual a 1,044 g/cm³ e as massas molares: H = 1,0 g/mol; Cl = 35,5 g/mol.
A alternativa que completa CORRETAMENTE a lacuna é:
KHC8H4O4 + NaOH → NaKH(C8H4O4) + H2O
Assinale a alternativa que responde CORRETAMENTE à questão.
( ) Tampão é uma solução que contém concentrações suficientes de um ácido fraco e de sua base conjugada. ( ) O ácido acético possui pKa = 4,75. Uma solução de ácido acético (HAc) e acetato de sódio (NaAc) funcionará como um tampão eficaz na faixa de pH de 2,75 – 6,75. ( ) Uma solução tampão, de pKa = 4,74, formada por HAc 0,1 mol/L e NaAc 0,1 mol/L, tem pH = 4,74. ( ) Quanto maior for a variação de pH após a adição de ácido forte ou de base forte, mais eficiente será a solução tampão.
Amostra X: Pesar 18 g de Polipropilenoglicol; diluir até 200 mL. Amostra Y: Pesar 20 g de Polipropilenoglicol; diluir até 200 mL. Amostra Z: misturar as amostras X e Y; diluir até o volume de 500 mL.
Assinale a alternativa que apresenta a concentração CORRETA de polipropilenoglicol na solução Z:
Texto para a questão.
A exploração, em sala de aula, do tema sabões e detergentes permite diferentes enfoques e técnicas de ensino, que promovem o pensamento crítico dos alunos por se tratar de um tema organizador relacionado a seu cotidiano. Tal proposta valoriza o aluno como indivíduo pensante, promovendo o papel do professor a mediador e orientador do processo educacional. Isso valoriza o papel desempenhado pela escola e contribui com o processo de aprendizagem da química, favorecendo, encorajando e sustentando a autoconstrução e o desenvolvimento do conhecimento por parte dos alunos. Nesse contexto, a equação genérica seguinte descreve o processo de saponificação, em que R corresponde a cadeias iguais ou diferentes, contendo entre 12 e 18 átomos de carbono.

Com base nesse caso hipotético, assinale a alternativa que apresenta o valor mais próximo da massa de NaOH necessária para essa reação.
Internet: <http://portal.anvisa.gov.br> (com adaptações).
Ao analisar a problemática do uso desse medicamento contaminado, observa-se a importância social do conhecimento químico. Considerando essa informação e que o produto de solubilidade (Kps) do BaSO4 é igual a 1 x 10-10, assinale a alternativa correta.
Considere a reação do hidroxi‐benzeno com excesso de HOBr. O ácido hipobromoso é obtido por meio da reação:
Br2 + 2 H2O → HOBr + Br– + H3O+ .
Indique a alternativa que apresenta o produto final e o tipo de reação ocorrida entre o hidróxi‐benzeno e o HOBr.
A reação entre metanol e ácido bromídrico segue o seguinte mecanismo:
(1) CH3OH + H+ ↔ CH3OH2+ (rápida)
(2) CH3OH2 + → CH3OH + H+ (rápida)
(3) CH3OH2 + + Br- → CH3Br + H2O (lenta)
A partir deste mecanismo, indique a alternativa que apresenta a lei de velocidade de formação do brometo
de metila, d[CH3Br]/dt, por meio da citada reação.
6 H+ + 5 H2C2O4 + 2 MnO4- → 10 CO2 + 2 Mn2+ + 8 H2O
determine a porcentagem em massa de carbonato de cálcio na referida mistura de cloretos.