Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 327 questões
Nessas condições, qual é o percentual aproximado de ferro no minério obtido?
Julgue o item de quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Suponha‐se que uma amostra de carbonato de cálcio de
massa igual a 100 g seja aquecida até ser decomposta.
Nesse caso, considerando‐se a massa molar do carbono
igual a 12 g mol−1, a massa molar do oxigênio igual a 16
g mol−1 e a massa molar do cálcio igual a 40 g mol−1, a
massa residual de sólido obtido será menor que 46 g.
O volume necessário da base, sabendo que o efluente tem o volume de 2500 L e concentração 0,500 mol/L, é
Fe3O4 + CO (g) → FeO (s) + CO2 (g)
Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
O dióxido de carbono gerado em estações espaciais pode ser convertido em oxigênio pela reação com o superóxido de potássio, conforme a equação a seguir.
2CO2(g) + 4KO2(s) → 2K2CO3(s) + 3O2(g)
Tendo como referência a reação precedente, assinale a opção que apresenta a massa exata de KO2 necessária para a conversão total de 11,2 L de CO2 em oxigênio nas condições normais de temperatura e pressão (CNTP), considerando que o valor do volume molar de um gás ideal nas CNTP seja 22,4 L e que todos os gases comportem-se idealmente.
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
O sulfato de alumínio pode ser obtido a partir da reação representada na equação não balanceada:
Al2 O3 (s) + H2 SO4 (aq) → Al2 (SO4 )3(aq) + H2 O(l)
Quando o balanceamento da equação é feito usando-se o coeficiente 1 para Al2 O3 , os coeficientes para o H2 SO4 e para H2 O são, correta e respectivamente,
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
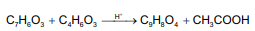
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
Dado: MM CuCl = 99 g.mol-1
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
A fórmula estrutural de um hidrocarboneto é representada
a seguir:
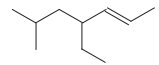
Este hidrocarboneto é nomeado
Uma solução de permanganato de potássio pode ser titulada com solução de oxalato de sódio em meio ácido, de acordo com a reação não balanceada:
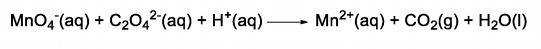
A semirreação de redução está corretamente representada em:
Considere a reação ácido-base de Lewis entre gás clorídrico e amônia:
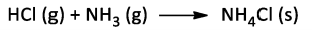
Considerando 100% de rendimento, calcule o volume mínimo da mistura equimolar dos reagentes, a 27ºC e 1 atm, de
modo que seja possível a obtenção de 10,7g do produto. Massas molares (g/mol): H = 1; N = 14; Cl = 35,5.
Um acidente ambiental provocou a contaminação das águas de um estuário com chumbo. Uma amostra de 200,0 mL foi coletada para análise e todo o chumbo foi precipitado na forma de PbSO4 devido ao tratamento da amostra com ácido sulfúrico. Sabendo que a massa obtida de PbSO4 foi 6,06 mg, qual é a concentração de chumbo na amostra, em mg/L?
Massas molares (g/mol): O = 16; S = 32; Pb = 207.
