Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 778 questões


Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a
176,0 g/mol.


Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir.
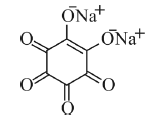
Considere que na reação do bário com o rodizonato de sódio, mostrado na figura a seguir, haja apenas troca de cátions para gerar a coloração laranja. Nessa situação, para formar o composto rodizonato de bário, serão necessários mais de 1.000 μg de rodizonato de sódio para reagir totalmente com 1.306,5 μg de nitrato de bário.
C6H12O6(aq) → C2H6O(aq) + CO2(g)
(Massas molares (g mol-1 ): C = 12; H = 1; O = 16)
Qual é a massa, em gramas, de CO2 produzida quando 0,400 mol de glicose reage dessa maneira?
___ P + ___ HNO3 + __ H2O →__ H3PO4 + 5 NO
Após balanceamento, a soma dos coeficientes estequiométricos dos reagentes é __________. Nesta reação, o __________sofre oxidação e o __________sofre redução.
Assinale a alternativa que apresenta as palavras que preenchem CORRETAMENTE as lacunas, na ordem em que aparecem no texto:
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
A reação de cloro gasoso com uma base forte pode ser descrita pela equação
Cℓ2(g) + 2 NaOH(aq) → NaCℓ(aq) + NaOCℓ(aq) + H2O(ℓ)
Para o posterior preparo de 0,5 litro de solução 0,2 mol.L–1 de hipoclorito de sódio obtido por meio desse processo, a massa de hidróxido de sódio que deve reagir em presença de excesso de cloro gasoso é, no mínimo, igual a
Dados: Massas molares H = 1g.mol–1 ; O = 16g.mol–1 Na = 23g.mol–1
Nas estações de tratamento de água, uma das principais etapas para obtenção de água potável consiste na eliminação das impurezas que se encontram em suspensão, que pode ser realizada a partir da adição de sulfato de alumínio, Aℓ2(SO4)3, e de hidróxido de cálcio, Ca(OH)2, à superfície da água a ser tratada. O hidróxido de alumínio produzido atua como floculante, arrastando impurezas sólidas para o fundo do tanque no processo de decantação e, em seguida, o sobrenadante é filtrado e desinfetado. O esquema simplificado mostra as etapas do tratamento de água utilizado pelas estações convencionais, para transformar água captada dos reservatórios naturais em água potável.
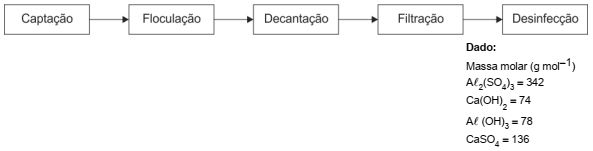
Em um teste piloto de tratamento de 0,50 m3 de água, foram adicionados 3,42 kg de sulfato de alumínio e 0,50 kg de hidróxido
de cálcio. Admitindo que não haja variação de volume é correto afirmar que
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
Alguns ácidos do elemento enxofre são: ácido sulfuroso, ácido tiossulfúrico, ácido sulfídrico e ácido sulfúrico.
As fórmulas químicas desses ácidos estão, respectivamente, apresentadas em:
Na determinação da Demanda Química de Oxigênio (DQO) o excesso de dicromato utilizado como oxidante é titulado pelo sulfato ferroso amoniacal, segundo a reação iônica mostrada abaixo.
Fe2+ + Cr2 O2-7 + H+ → Fe3+ + Cr3+ + H2O
A soma dos coeficientes que tornam a reação corretamente balanceada é
O minério magnetita é formado pelo seguinte processo:
3FeO (s) + CO2 (s) à Fe3O4 (s) + CO (g)
Quantos mols, aproximadamente, de dióxido de carbono são necessários para reagir com 750 g de óxido de ferro(II)?
Dados:
(massa molar do FeO = 71 g/mol; massa
molar do CO2 = 44 g/mol)
