Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 327 questões
A fórmula molecular da referida substância orgânica é
Considerando que a estequiometria tem base em leis ponderais e compreende cálculos e regras para determinar a correta proporção das substâncias que se pretende utilizar, julgue o item a seguir.
Os coeficientes estequiométricos em uma reação química
podem ser determinados por tentativas; nesse caso, a fim de
melhorar a assertividade, são utilizadas algumas regras
empíricas, por exemplo, aquela em que se balanceiam, por
último, o carbono, o hidrogênio e o oxigênio, nessa ordem.
Qual a quantidade de água, em mL, que deverá ser adicionada para que a concentração do soluto seja reduzida para 0,04 mol/L?
Com relação às reações químicas abaixo:
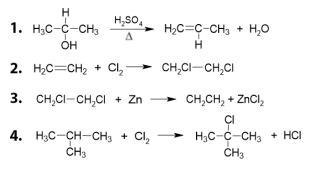
é correto afirmar que são, respectivamente, reações de
A fórmula estrutural deste antibiótico é mostrada a seguir:
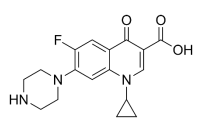
Com base na fórmula estrutural do ciprofloxacino, é correto afirmar que:
A fórmula estrutural desta substância é mostrada abaixo:
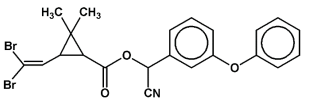
Sobre essa substância, é correto afirmar que:
CaCO3 + H3PO4 ➜ CaHPO4 + CO2 + H2O
Considere que se disponha de 100 kg de calcário (com teor de 90% em CaCO3) para reagir com ácido fosfórico (H3PO4) e formar fosfato bicálcico.
Qual a quantidade, em massa, de sal formado?
A solução de sulfato de cobre penta-hidratado possui 0,9988 g e a massa molar é 249,7 g/mol, já o KIO3 possui massa molar igual a 214,0 g/mol.
Qual a massa de KIO3, em gramas, necessária para que ocorra a precipitação?
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Balanceando-se a equação de oxirredução acima com algarismos inteiros, determina-se que o somatório de todos os seus coeficientes estequiométricos é igual a
Assinale a alternativa que aponta as corretas. Amedeo Avogadro postulou a hipótese de que volumes iguais de gases sob as mesmas condições de temperatura e pressão contém o mesmo número de constituintes. Com isto, o conceito de volume molar corresponde:
I - (Vm) é o volume ocupado por um mol de entidades elementares de uma substância.
II - A massa de uma substância é o mol dela mesma.
III - O volume molar pode se referir também ao volume da substância no estado sólido.
IV - O volume molar de qualquer gás nas CNTP é igual a 22,71 L/mol.
V - O mol é definido a partir do valor da massa atômica.
Considere as massas molares (g.mol-1 ):
Fe2O3 = 159,69; FeSO4 = 151,91; (NH4)2SO4 = 132,14.
A pureza (%) da amostra é, aproximadamente,