Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 327 questões
SO3(g) +H2SO4(l) → H2 S2 O7(l) (Equação1) H2S2O7(l) + H2O(l) → 2H2 SO4(l) (Equação2)
CAMPOS, R. V. Ácico Sulfúrico. Rev. Virtual Quim. 2011, 3(3), 210-214 (adaptado).
Para a produção do ácido sulfúrico 98% m/m, a indústria partiu de 800kg de SO3 e 980kg de H2SO4, além de água o suficiente para obtenção desse produto. A massa de ácido sulfúrico 98% m/m que se pode obter, em kg, é
Dados: Massa molar: O=16g/mol; H=1g/mol; S=32g/mol
Dados: MMFe = 56 g mol-1 MMO = 16 g mol-1
O processo de obtenção consiste na calcinação da mistura de sílica (SiO2) com carbonato de sódio (Na2CO3), produzindo o silicato de sódio e gás carbônico. Este processo apresenta rendimento de 70%.
A massa de silicato de sódio que poderá ser obtida por este processo, a partir de 3,0 kg de sílica, é: Dados: Massas molares em g.mol–1 Si = 28; O = 16; Na = 23; C = 12.
As armas de fogo são artefatos de dimensões e formas diversas que arremessam um ou mais projéteis utilizando a força de expansão de gases resultantes da combustão da pólvora. Atualmente se utilizam pólvoras baseadas em nitrocelulose e nitroglicerina, mas antigamente as armas de fogo usavam a pólvora preta, cuja combustão é representada pela equação a seguir, que está desbalanceada:
S(sol.) + C(sol.) + KNO3 (sol.) → CO2 (g) + N2 (g) + K2S (sol)
A equação equilibrada estequiometricamente é
O oxigênio representa aproximadamente 20% (em volume) do ar atmosférico em relação aos outros gases presentes na mistura. Quando o oxigênio e o monóxido de carbono se encontram, ocorre a seguinte reação química.
CO (g) + ½ O2 (g) → CO2 (g)
Nessa situação, considerando que todos os gases estejam submetidos à mesma pressão e temperatura, o volume de ar necessário para a combustão completa de 20 L de monóxido de carbono é
Acerca de estequiometria, julgue o item que se segue.
As bases fundamentais da estequiometria são a lei das
proporções definidas, a lei das proporções múltiplas e a lei
das proporções equivalentes.
Acerca de estequiometria, julgue o item que se segue.
Em uma reação química, o reagente limitante serve de base
para o cálculo do rendimento teórico.
Considerando-se que os óxidos são compostos inorgânicos com diversas aplicações na indústria química, julgue o item subsequente.
O químico francês Joseph Proust elaborou a lei da
conservação das massas.
A partir desses dados, a perita conseguiu determinar a fórmula empírica como sendo:
Por exemplo, pode-se produzir 448cm3 de H2 nas CNTP reagindo alumínio (peso molecular de 27g) com excesso de uma solução aquosa de HCl, desde que seja usada a seguinte quantidade de átomos de alumínio:
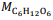 = 180 g/mol e
= 180 g/mol e 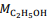 = 46 g/mol.
= 46 g/mol. De acordo com a reação descrita, para a obtenção de 1,0 kg de etanol, são necessários mais de 2,0 kg de glicose.
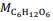 = 180 g/mol e
= 180 g/mol e 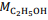 = 46 g/mol.
= 46 g/mol. De acordo com a lei de Lavoisier, na reação de fermentação da glicose para produzir somente etanol e gás carbônico, em recipiente fechado, a massa de glicose consumida é igual à massa de etanol produzida, que é igual à massa de CO2 liberada.
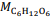 = 180 g/mol e
= 180 g/mol e 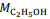 = 46 g/mol.
= 46 g/mol. A química distanciou-se da alquimia a partir dos ensaios de Robert Boyle, um dos primeiros pesquisadores a dar forma científica ao atomismo, opondo-se a Aristóteles e Paracelso.
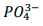 foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]:
foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]: Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
Al(OH)3(s) + 3 HCl(aq) → AlCI3(aq) + 3 H2O(I)
Mg(OH)2(s) + 2 HCl(aq) → MgCl2(aq) + 2 H 2O(I)
No período de 18 horas, a massa de ácido clorídrico neutralizado em miligramas e a quantidade de moléculas de HCl consumida, na neutralização, foram respectiva e aproximadamente:
Dados: Massas Molares: Mg(OH)2 = 58 g/mol; Al(OH)3 = 78 g/mol; HCl = 36,5 g/mol; Constante de Avogadro = 6,0.1023
3 Fe2O3(s) → 2 Fe3O4(s) + 1/2 O2(g)
A porcentagem de Fe e a porcentagem de Fe3O4 presentes na amostra, são respectiva e aproximadamente:
Dados: Fe = 55,847 g/mol; Fe2O3 = 159,69 g/mol Fe3O4 = 231,54 g/mol
P2O5(S) + 9 H2O(I) → 2PO43- (aq) + 6 H3O+(I)
2 PO43-(aq) + 6 Ag+(aq) → 2 Ag3PO4(S)
Ag+(aq) + SCN-(aq) → AgSCN(s)
Sendo assim, a porcentagem de P2O5 presente na amostra é, aproximadamente, igual a:
Dados: Massas molares em g/Mol C = 12,01 N = 14,00; O = 16,00; P = 30,97; S = 32,06; Ag = 107,87
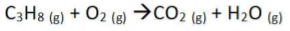
O balanceamento da equação é dado pelos coeficientes estequiométricos, nesta ordem: