Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
O volume de solução estoque em pregada para a preparação da
solução desejada foi superior a 8,0 mL.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
De acordo com os dados fornecidos no rótulo do frasco, a
concentração da solução estoque de NH4OH é superior a 7,0
mol/L.
Considerando que foram misturados 6g de KOH com 10g de H2SO4, o valor encontrado para a massa formada de K2SO4 é de, aproximadamente,
Considerando que o teor máximo de acidez do vinagre é de 6,00% de ácido acético, os valores obtidos na análise são
Ao final, ele obteve um suco com concentração hidrogeniônica de
A massa de bórax necessária para preparar 1L de uma solução a 0,1mol/L é
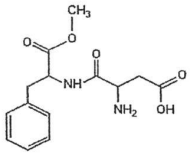
Fonte: FUNCERN, 2015.
Sabendo que a fórmula molecular da sacarose é C12H22O11, a quantidade de sacarose que corresponderá a 5 g de aspartame é
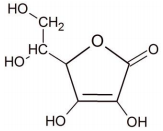
Fonte: FUNCERN, 2015.
Sabendo que um comprido efervescente contém 1 g desta vitamina, a relação entre a quantidade ingerida de vitamina C e a quantidade indicada para ingestão é
NaOH HF HCl SiC Fe
Com relação a essas substâncias, é correto afirmar:
As reações de hidroformilação são catalisadas por complexos de metais de transição, sendo os complexos de ródio (Rh) os mais ativos. Quando se deseja isolar o aldeído, um dos precursores catalíticos mais empregados é o RhH(CO)(PPh3)3, no qual PPh3 representa uma molécula de trifenilfosfina (três grupos fenil ligados a um átomo de fósforo). Por outro lado, o emprego do catalisador Rh(cp)(CO)2(PBu3), por exemplo, tem permitido a obtenção direta de álcoois.

Considerando ΔT como o parâmetro de desdobramento do campo cristalino e que a geometria do complexo Rh(cp)(CO)2(PBu3),apresentada, seja tetraédrica, julgue o item subsequente.
A estrutura e as cargas formais da molécula de CO estão corretamente representadas na estrutura a seguir.
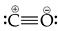
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
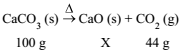
A massa, em gramas, correspondente a X é igual a
Este relato é um histórico importante sobre o elemento ferro, que pode ser obtido através da hematita (óxido férrico). Para a formação da hematita ocorre uma reação entre ferro metálico e gás oxigênio. Considerando este processo químico, quantas gramas de hematita, podem ser obtidas quando 20 mols de ferro reagem com quantidade suficiente de oxigênio? Assinale a alternativa CORRETA.
O ácido sulfúrico é muito importante na indústria, pois é utilizado no refino de petróleo, na fabricação de explosivos, na indústria de fertilizantes, bem como emprego para obtenção de outros ácidos. Este é considerado um _______________, pois apresenta _______________, possuindo fórmula molecular_______________.
Assinale a alternativa que completa, CORRETA e respectivamente, as lacunas do texto acima:
1ª análise: foram gastos na titulação 21,3 mL da amostra de NaOH.
2ª análise: foram gastos na titulação 22,0 mL da amostra de NaOH.
3ª análise: foram gastos na titulação 21,5 mL da amostra de NaOH.
(Dado: equação da reação, NaOH(aq) + HOOCC6H4COOK(aq) → NaOOCC6H4COOK(aq) + H2O(liq); NaOH = 40,00 g mol-1 e KHC8H4O4 = 204, 22 g mol-1).
A concentração da solução de NaOH padronizada é:
NaHCO3 + HCl → NaCl + H2O + CO2
Podemos afirmar que o grau de pureza da amostra de bicarbonato de sódio é