Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
Uma solução de 10mL do ácido acetilsalicílico (AAS) 0,1mol/L foi titulada com NaOH 0,1mol/L. Considere que o volume da base adicionada foi de 5mL e o Ka do AAS é igual a T.
Nessas condições, é CORRETO afirmar que a concentração de íons H+ em mol/L no meio reacional é igual a
A análise quantitativa representa, junto à indústria, um papel fundamental, já que abrange o exame de matérias-primas, o controle de materiais nas várias fases de produção e a avaliação da qualidade dos produtos, entre outros.
A equação química da reação do permanganato de potássio (KMnO4) com oxalato de sódio (Na2C2O4) em meio ácido é
2MnO4- + 5C2O42- + 16H+ -> 2Mn 2+ + 10CO2 + 8H2O
Considere que numa titulação de 0,2g de Na2C2O4 puro foram necessários 60 mL de solução de permanganato de potássio (KMnO4).
Nessas condições, é CORRETO afirmar que a concentração molar da solução de KMnO4 é aproximadamente igual a
A fabricação do gás cloro a partir da eletrólise de uma solução de cloreto de sódio pode ser representada pela seguinte equação química: 2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2. Qual a massa, em kg, de gás cloro que é obtida a partir de 10 m3 de salmoura contendo 10% em massa de NaCl?
Dados: massa específica da salmoura = 1072 kg m-3 e as massas atômicas, em kg kmol-1, H = 1, O = 16, Na = 23 e Cl = 35,5
A questão 58 refere-se à tabela seguinte.
Dados da Tabela de vapor |
Entalpia Específica H (kJ.kg-1) |
Entropia Específica S (kJ.kg-1) |
Vapor superaquecido a 8600 kPa e 500°C |
3392 |
6,65 |
Vapor saturado a 10 kPa |
2590 |
8,15 |
Líquido saturado a 10 kPa |
190 |
0,65 |
0,5 kg.s-1 de vapor d’água saturado a uma pressão de 10 kPa é usado para aquecer uma corrente de benzeno de 5°C até 45°C num trocador de calor. Considerando qu e a água sai como líquido saturado do trocador na pressão de 10 kPa e que a capacidade calorífica média do benzeno líquido é de 2,0 kJ.kg-1.K-1, a vazão mássica de benzeno para promover tal aquecimento é de (despreze as perdas no trocador)
Em uma sala de 300 m3 que possui umidade relativa de 60%, o ar está a 27°C e a 102,2 kPa. Nessa temperat ura, considere que a pressão de vapor da água é, aproximadamente, de 4 kPa e a razão de umidade é de 0,02 kg de água por kg de ar seco. A massa de vapor d’água presente na sala é de
Dados adicionais: R = 8,314 kJ.kmol-1.K-1; Massa molar do ar: 29 kg.kmol-1
A adição de íons fluoretos a água potável tem como objetivo prevenir o surgimento de cáries na população. Devido a possível toxicidade quando em doses elevadas, à concentração deste íon na água para consumo humano não deve ultrapassar o valor limite de 1 mg . L-1. Esta concentração pode também ser representada por
Acerca do modelo de ligação iônica, analise as afirmativas.
I. Apresenta elevados pontos de fusão e ebulição nas condições ambientes.
II. Conduz corrente elétrica no estado sólido, quando fundido ou em solução aquosa.
III. É duro e quebradiço, originando fragmentos de faces planas.
IV. A massa molar da molécula de NaCl é 58,5 g mol1 .
Estão corretas as afirmativas
Analise as seguintes afirmativas.
I. No sistema internacional de unidades (SI), número de mols é a grandeza física que tem mol como unidade.
II. O mol é definido pelo SI como a quantidade de matéria de um sistema contendo tantas entidades elementares quanto os átomos que existem em 0,012 kg de 12C.
III. 1 mol de entidades elementares está relacionado com 6,022 x 1023 unidades.
Está(ão) correta(s) a(s) afirmativa(s)
A análise de uma bebida carbonatada indicou um pH = 4. Qual a concentração, em mol L-1, de íons H+ nesta bebida?
A reação de neutralização entre o ácido sulfúrico e o hidróxido de alumínio ocorre com rendimento de 90%. Supondo que são utilizados 60 moles de ácido sulfúrico e 40 moles de hidróxido de alumínio, a massa de sulfato de alumínio formada será, aproximadamente, de
(Números atômicos dados: Al = 27; H = 1; O = 16; S = 32)
O CaCO3 (principal componente das rochas calcárias) é utilizado para a produção da cal extinta [Ca(OH)2], através de duas reações. A primeira é a decomposição térmica do carbonato de cálcio: CaCO3(s) → CaO(s) + CO2(g) e a segunda é a hidratação do óxido de cálcio formado: CaO(s) + H2O(l) → Ca(OH)2(s). Qual a massa, em kg, de cal extinta que é produzida através destas reações, quando se utiliza uma tonelada de rocha calcária contendo 95% em massa de CaCO3 e 5% de impurezas? Considere que as impurezas presentes na rocha calcária não participam das reações envolvidas no processo.
Dados: massas atômicas, em g mol-1, do H = 1, C = 12, O = 16, Ca = 40.
Uma amostra de 7,00 g de um pesticida contendo DDT (C14H9Cl5) foi decomposta com sódio metálico usando álcool como solvente. Os íons cloretos liberados na reação foram precipitados como AgCl. Qual o percentual de DDT na amostra, sabendo-se que foram recuperados 0,34 g de AgCl?
Dados: massas atômicas, em g mol-1, H = 1, C = 12, Na = 23, Cl = 35,5 e Ag = 108.
Em uma titulação de precipitação de 100 mL de NaCl 0,1M por uma solução de AgNO 0,5 M serão gastos:
Em uma indústria química, houve um derramamento acidental de H2SO4 (98 g/mol), na concentração de 8 mol/L, causando a dispersão de 200 L deste ácido em um pequeno lago. Uma equipe de técnicos foi chamada para tentar minimizar os danos para o ecossistema deste lago. Essa equipe decidiu que a adição de bicarbonato de sódio NaHCO3 (84 g/mol) seria a melhor solução imediata para tentar recuperar o lago. A massa de mínima de NaHCO3, necessária para reagir com o ácido derramado, é:
Uma substância muito utilizada para produção, em escala industrial, de bombas incendiárias e granadas luminosas é o fósforo branco, P4(s) Seu processo de fabricação consiste no aquecimento de fosfato de cálcio, areia e coque, segundo a reação química descrita abaixo. A alternativa que demonstra os coeficientes para o balanceamento correto da reação é:
Ca3(PO4)2(s) + (SiO2)n(s) + C(s) CaSiO3(s) + CO(g) + P4(s)
A reação de neutralização do ácido acético é dada pela equação abaixo.
CH3COOH + NaOH → CH3COONa + H2O
Para preparar 25 mL de solução de ácido acético a 20 g/L, qual seria a quantidade necessária de NaOH para neutralizar esta reação?
Adotar: C = 12 g/mol, O = 16 g/mol, H = 1 g/mol e Na = 23 g/mol
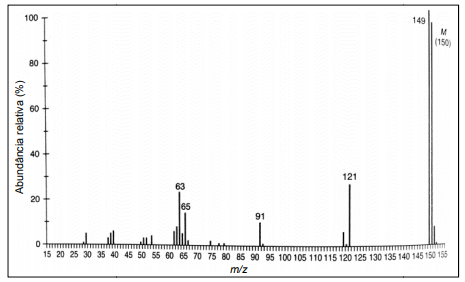
O laboratório que está sujeito à norma na questão anterior é um gerador contínuo de resíduos de mercúrio. O tratamento adequado desses resíduos consiste na sua acidificação com ácido nítrico seguido da adição de tioacetamida (CH3SNH2). Esse último sofre decomposição, gerando íons sulfeto em meio ácido.
Dados: M (g.mol-1 ): Hg = 200; S = 32; N = 14; H = 1; KPS: HgS = 2 x 10-53 .
Uma bombona de 20L contém um resíduo de mercúrio em concentração de 0,1 mol.L-1 . Qual é a massa (em gramas) mínima necessária de tioacetamida para tratar esse resíduo?