Questões de Química - Representação das transformações químicas para Concurso
Foram encontradas 1.436 questões
I. A densidade também pode ser considerada como sendo 9,00.102 g/L.
II. Se um rótulo informa que tem 50,0Kg de etilenodiamina, então, o volume da embalagem tem que ser maior do que 100L.
III. É possível considerar que o teor de etilenodiamina é 90,0%(m/v).
IV. A concentração da solução de etilenodiamina pode ser considerada como sendo 15,0mol/L.
É correto o que se afirma em
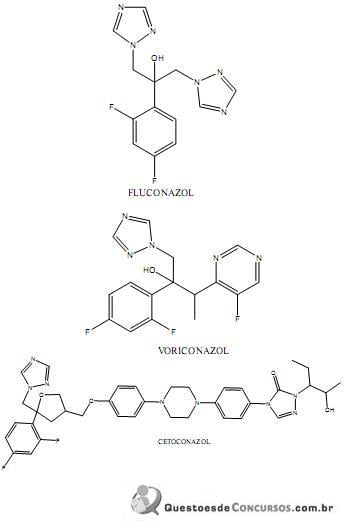
Diante do exposto, assinale a alternativa incorreta.
Pb(NO3)4(s) → Pb(s) + N2O4(g) + O2(g)
(Dado de massas molares (g/mol): Pb(NO3)4 = 455; Pb = 207; N2O4 = 92, O2 = 16)
Então, é correto afirmar que a massa total de nitrato de chumbo (IV) presente na amostra é de, aproximadamente,
(Dados: massas molares (g/mol): Mg = 24; Cl = 35,5; H = 1; O = 16)
Na2SO4(aq) + BaCl2 (aq) → NaCl(aq) + BaSO4 (s)
(Dados de massas atômicas (u): Na = 23; S = 32; O = 16; Ba = 137; Cl = 35,5)
Se 50,00mL da solução de sulfato de sódio consome 12,25mL de uma solução a 0,02mol/L de cloreto de bário, assinale a alternativa que apresenta a massa de sulfato de sódio presente.
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
Dados
Massa atômica do cálcio = 40 g
Massa atômica do fósforo = 31 g
Massa atômica do oxigênio = 16 g
Fe2 O3 + C → Fe + CO2
Sabendo-se que foram produzidas 42 gramas de ferro, o grau de pureza da hematita utilizada é de
Dados
Massa atômica do ferro = 56 g
Massa atômica do oxigênio = 16 g
Massa atômica do carbono = 12 g
A soma dos coeficientes da equação acima, acertados pelo método redox, corresponde a
Se a massa específica do ouro é igual a 1,97 x 104 kg/m3 , o número de átomos de ouro presente na nanopartícula é igual a
Dado
Constante de Avogadro = 6 x 1023 mol -1
• seu cátion corresponde ao elemento químico de maior raio atômico do bloco s da tabela de classificação periódica dos elementos;
• seu ânion corresponde ao elemento químico de maior energia de ionização do grupo VIIA da tabela de classificação periódica dos elementos.
A fórmula mínima desse sal é
A fórmula química do ânion desse sal é
A concentração, em mol/L, da solução diluída é igual a
Dado
massa molar do H2 SO4 = 98 g/mol
NaNO3(s) + H2 SO 4(aq) → NaHSO4(aq)+ HNO3(aq)
Uma amostra de salitre do Chile apresentando 85% de pureza reage com excesso de ácido sulfúrico produzindo 315 g de ácido nítrico.
A massa, em gramas, de salitre do Chile empregada no processo é de
As fórmulas que correspondem ao nitrato de cálcio, ácido fosfórico, hidróxido de amônio e hipoclorito de sódio, são, respectivamente,