Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
2H2O2(aq) → 2H2O(l) + O2(g)
Por ser considerada uma reação lenta em condições normais, os estudantes utilizaram, como catalisador, o cloreto férrico. O estudo foi conduzido de maneira que a concentração remanescente de H2O2 fosse determinada, de tempo em tempo, durante a reação, por meio da titulação de oxirredução de alíquotas de 5,0 mL da mistura reacional com permanganato de potássio em meio ácido. A reação não balanceada envolvida na titulação é dada pela equação:
MnO4 - ( aq) + H2O2(aq ) + H +( aq) Mn 2+ ( aq) + H2O( l ) + O2(g).
Após os resultados, os estudantes plotaram o logaritmo natural da concentração da água oxigenada remanescente em função do tempo, obtendo o seguinte gráfico:

Considerando o comportamento ideal para o gás, a decomposição completa de 17,0 g de água oxigenada em H2O( l ) e O2 (g) libera um volume de O2(g), medido nas CNTP, superior a 5,0 L.
Considerando-se que o percentual em massa de HCl no estoque é 36,5% e sua densidade específica é 1,2, é CORRETO afirmar que a concentração da solução preparada pelo técnico é igual a
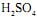 de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada,
de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada, 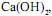 em gramas, igual a
em gramas, igual a 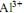 em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal
em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal 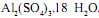 A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a
A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a As lacunas desse texto são, correta e respectivamente, preenchidas por:
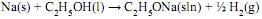
Para eliminar um resíduo de 230 mg de sódio, a massa necessária de etanol é, em miligramas, igual a
Dados
MO = 16 g mol -1
MN = 14 g mol -1
MH = 1 g mol -1
5H2 C2 O4 + 2KMnO4 + 6H+
→
10 CO2 + 2Mn2+ + 8H2 OO volume, em mL, de solução de KMnO4 0,165 mol/L, necessário para reagir com 108 mL de ácido oxálico, de igual concentração molar, é
Sobre essa solução, é correto afirmar que
Dado: massa molar Mg(NO3 )2= 148 g. mol –1
2 Ca3 Si O5 + X H2O → ( 3 CaO . 2 Si O2 . 4 H2 O ) + Y Ca( OH)2 + 173,6 kJ
Os coeficientes estequiométricos X e Y são, respectivamente,
H2 + 1/2 O2 → H2O
Nesse processo, quantos mols de O2 são necessários para produzir 10 mols de H2 O?
Na reação de oxirredução representada pela equação não balanceada acima, o número de oxidação médio do.
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

concentração de NaCl, em mol/L, no corpo de um adulto corresponde aproximadamente a
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

Uma amostra contendo 2 g de um cereal enriquecido com ferro (II) foi transferida para um frasco contendo solução aquosa de ácido sulfúrico e em seguida titulada com solução padronizada de KMnO4 , conforme descrito na literatura. A equação iônica da titulação está representada a seguir:
MnO4 – (aq) + 8H+ (aq) + 5Fe2+ (aq) ? Mn2+ (aq) + 4H2 O (l) + 5Fe3+ (aq)
Terminada a titulação, calculou-se que foram consumidos 0,00075 mol de KMnO4 . Sabendo que a massa molar do Fe é 56 g/mol, a quantidade, em g de ferro (II) na amostra analisada é