Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
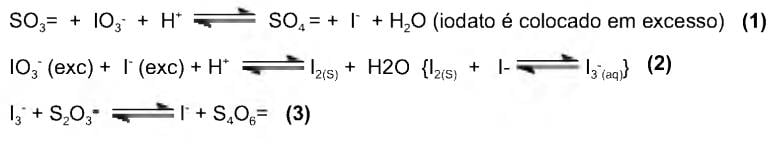
Mn04- + Fe 2+ + H+ —> Mn 2+ + Fe3+ + H20
Quantos mililitros de uma solução 0,0240 mol L-1 são necessários para titular 20,00mL de uma solução 0,112 mol L-1 em Fe2+ .
 H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
H0c), definido como a energia liberada na queima completa de um mol de combustível no estado padrão. A Tabela 68 apresenta a relação entre alguns combustíveis.
Neste contexto, indique qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida.
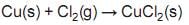
Uma mistura em equilíbrio contém 20 g de Cu, 35 g de Cl2 e 198 g de CuCl2 num recipiente de 2,5 L de capacidade. Identifique a alternativa que apresenta, respectivamente, as concentrações molares (mol/L) do Cu, Cl2 e do CuCl2.
Na + KNO3 → Na20 + K20 + N2
Quantos gramas de Ca3(P04)2 são formados?
Se 215g de hexano são misturados com 215g de 0 2, as massas de C02 e H20 produzidas na reação são, respectivamente:
COBr2(g) ⇆CO(g)+Br2(g)
K é 0,190 a 73°C. São colocados 0,500 mol de COBr2 em um frasco de 2L com aquecimento até 73°C. Que porcentagem de COBr2 original se decompõe a essa temperatura?
xC4H10 + y02 → wC02 + zH20
A equação química acima descreve a queima do gás metano, uma reação de combustão muito utilizada na indústria. A partir dessas informações, julgue os itens a seguir.
A equação química acima descreve a queima do gás metano, uma reação de combustão muito utilizada na indústria. A partir dessas informações, julgue os itens a seguir.
Fe (s) + H2 SO4 (aq) → FeSO4 (aq) + H2 (g)
Ao término da reação, o ácido foi totalmente consumido, sobrando ferro sem reagir. A solução resultante passou por um processo controlado de evaporação, obtendo-se o sal hidratado FeSO4 .7H2O. A massa do sal hidratado obtida deve ter sido, em gramas, aproximadamente igual a

