Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
 , etano
, etano 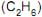 e propano
e propano 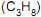 . Todos se encontram na pressão de 1 atm e a na mesma temperatura.
. Todos se encontram na pressão de 1 atm e a na mesma temperatura. Supondo os gases ideais e as suas características, considere as afirmativas abaixo.
I - O volume de oxigênio necessário para a combustão completa de todos os gases contidos nos três balões é o mesmo.
II - A densidade do etano é maior do que a do metano e menor do que a do propano.
III - A massa de propano contido num dos balões é igual à soma das massas do metano e etano contidos nos outros dois balões.
É correto APENAS o que se afirma em
Dados: C = 12; H = 1; R = 0.082 atm.L.mol -1 .K-1
I. A pressão parcial do metano é 0,6 atm.
II. A pressão total é 3,44 atm.
III. A fração em mol do butano é aproximadamente 0,5.
IV. A pressão parcial do propano é 0,615 atm.
V. A quantidade de matéria do propano é 0,11 mol.
verifica-se que estão corretas
Assinale a opção que contém a fórmula química desses sais, respectivamente.
Dados: H = 1; S = 32; O = 16; Na = 23
CrO4 2– + I ¯ → Cr3++ I2 + H2O
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
 Os menores coeficientes a, b, c, d, e e f que balanceiam esta equação correspondem, respectivamente, a:
Os menores coeficientes a, b, c, d, e e f que balanceiam esta equação correspondem, respectivamente, a: 
A quantidade mínima de moléculas de cloro para equilibrar essa reação, obedecendo às leis estequiométricas, é igual a:


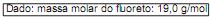
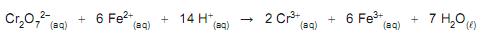
Considerando a estequiometria dessa reação, a porcentagem em massa de Fe na amostra analisada é, aproximadamente, igual a
Dado
M(Fe)=56g/mol
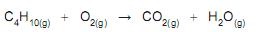
A massa de butano, em gramas, que mais se aproxima do valor que dá origem a 67,2 L de CO2 , nas condições normais de temperatura e de pressão, e considerando o comportamento de gás ideal (no qual o volume molar é igual a 22,4 L), é
