Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
Sabendo-se que um mol desse ácido tem 98 g, qual a concentração em mol/L dessa solução?
Zn + HCl → ZnCl2 + H2
A massa de HCl necessária para reagir completamente com 130 g de zinco é
Dados: mH = 1u, mCl = 35u e mZn = 65u
Ca + 2 H2 O → Ca(OH) 2 + H2
Qual a massa, em gramas, de H2 produzido na reação?
Dados: mH = 1u, mO = 16u e mCa = 40u
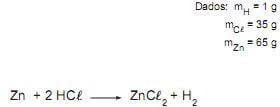

Qual a massa, em gramas, de gás carbônico que é produzida nessa reação se são consumidos 100 g de carbonato de cálcio?
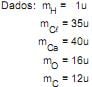
 em peso), completando-se com água até um volume final de 2,0 L.
em peso), completando-se com água até um volume final de 2,0 L. Qual o teor residual de prata na solução?
Dado: Ks AgC
 = 1,8 x 10-10
= 1,8 x 10-10 Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
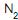 , de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de
, de acordo com as CNTP. Durante um determinado instante, a corrente escoa a 27 oC e a 1 MPa, e o sensor indica uma vazão de 1 000 m3 /h. Se, posteriormente, a temperatura e a pressão dessa corrente aumentarem para 87 oC e 2 MPa, mantendo, no entanto, a vazão mássica constante, o valor medido pelo sensor sofrerá uma variação de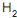 , uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de
, uma corrente de 17 400 kg/h de gás natural (composição volumétrica: 90% de 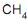 e 10% de
e 10% de 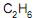 ) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é
) é misturada com vapor d´água de tal forma que a razão entre a quantidade de matéria de vapor e a quantidade de matéria total de carbono seja equivalente a 3. A vazão mássica da corrente de vapor é Dados: Massas molares: H = 1 kg/kmol; C = 12 kg/kmol; O = 16 kg/kmol
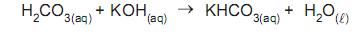
A fórmula estrutural do ácido carbônico é
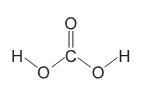
Na reação total, o sal formado e a proporção de reação do ácido com a base são, respectivamente,
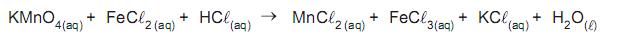
Com base nos coeficientes da equação balanceada, a proporção estequiométrica de reação entre as espécies KMnO4 e FeCl2 é
A mensagem CONTRARIA o(a)
6Fe2+(aq) + Cr2O72-(aq) + 14H+(aq) ? 6Fe3+(aq) + 2Cr3+(aq) + 7H2O(L)
Qual é a percentagem em massa de ferro na amostra?
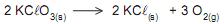
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é