Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.450 questões
Em uma reação de adição, do tipo A + B ↔ 2C, determine a velocidade da reação inversa, sabendo que a determinada temperatura a constante de equilíbrio da reação é 5,0 104, para [B] = 1,0 10-5 mol/L, [C] 4,0 10-3 mol/L e a constante de velocidade da reação direta igual a 2,0 10-6(mol/L s)-1.
A oxigenoterapia consiste no tratamento da hipóxia que é diminuição das taxas de oxigênio no sangue arterial ou nos tecidos. Esse tratamento consiste na inalação de oxigênio, a uma pressão maior que a do ar ambiente, o que facilita a troca gasosa e reduz o trabalho da respiração. (II Consenso Brasileiro de Ventilação Mecânica. J Pneumol 2000;26 (Suppl 2): S1-2.)
O gás oxigênio usado nesse tratamento pode ser comercializado em cilindros a elevada pressão. Supondo que o cilindro contém 200 cm3 de gás oxigênio (O2), submetido à temperatura constante de 150°C e pressão total de 1,0 atm. Assumindo que o O2 se comporta como gás ideal, assinale a opção CORRETA que apresenta os respectivos valores numéricos do número de moléculas e da massa específi ca, em kg m-3, desse gás quando exposto às condições de pressão e temperatura apresentadas. : (Dados: R=0,082 dm3 atm mol-1 K-1 Número de Avogadro 6,02x1023)
Uma central petroquímica utiliza carvão mineral como fonte de energia para a geração de vapor. O carvão utilizado contém, em média, 2% de seu peso de enxofre. A queima do carvão gera dióxido de enxofre, que será removido em um equipamento de remoção à base de dióxido de cálcio. A central petroquímica queima 3.000 toneladas de carvão por dia. Considerando a eficiência de conversão de 75%, qual a quantidade de dióxido de cálcio necessária para a remoção total do enxofre e a quantidade de sulfito de cálcio gerada diariamente, respectivamente?
O cloreto de cobalto (II) é um composto químico utilizado como indicador de umidade devido às suas diferentes formas anidra e hidratada apresentarem coloração bem distinta. A forma anidra CoCl2 é azul, e a forma hidratada (úmida) CoCl2·6H2O é rosa profundo. Esta característica o faz ser um dos mais comuns compostos de cobalto em laboratórios. A forma anidra pode ser preparada a partir do metal cobalto e gás cloro:
Co(s) = Cl2(g) → CoCl2(s)
Uma mistura em equilíbrio contém 20 g de CO, 35 g de Cl2 e 198 g de COCl2 num recipiente de 2,5 L de capacidade. Identifique a alternativa que apresenta, respectivamente, as concentrações molares (mol/L) do Co, Cl2 e do CoCl2, de forma correta:
Calcule a variação da entalpia (ΔH) para a reação global de formação de 0,325 ton calcita a partir de seus elementos constituintes utilizando as reações e os dados termodinâmicos fornecidos a seguir.
Use: Massa molar O = 16 g.mol-1,
I) C(s) + O2(g) ➔ CO2(g) ∆ H = -393,5 kJ mol-1
II) CaO(s) ➔ Ca(s) + 1/2O2(g) ∆H = +635,0 kJ mol-1
III) CaO(s) + CO2(g) ➔ CaCO3(s) ∆H = -178,3 kJ mol-1
Ni(s) + CO(g) → Ni(CO)4(g)
Considerando as massas molares, em g/mol, do Ni = 59, C = 12 e O = 16, qual a massa de Ni(CO)4 obtida, em kg, aproximadamente, dado que 20 kg de níquel metálico foram volatilizados?
Dados eventualmente necessários: massas molares (g/mol): A = 23; C = 12; O = 16; Cl = 35,5; H = 1.
Considerando a formação do metano, a partir da reação:
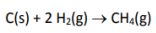
Assinale a alternativa que apresenta qual seria a quantidade em quilocalorias, em valor absoluto, envolvido na formação de 1 mol de metano dadas as seguintes variações de entalpia de combustão:
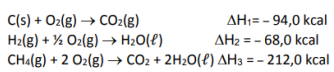
Assinale a alternativa correta.
IO3− + I− + H+ ⇌ I2 + H2O
Os menores coeficientes estequiométricos inteiros que balanceiam essa reação são, nessa ordem,
Nessa situação, as concentrações, em mol L-1 , remanescentes de brometo e iodeto dissolvidos em solução seriam, respectivamente,
Dado: Kps(AgBr) = 5 x 10-13 Kps(AgI) = 5 x 10-17
Considere a tabela abaixo para responder a questão 60:
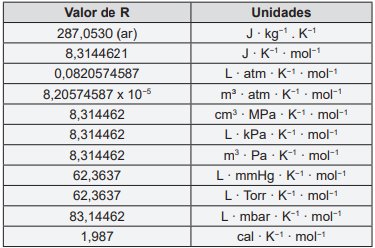
Analise as afirmativas abaixo e assinale a alternativa em que a obtenção do ferro a partir da hematita pode ser descrita pela equação: Fe2O3 + 3CO → 2Fe + 3CO2 .
I. A massa de ferro que será obtida a partir de 0,04 mol de óxido férrico é 4,48 g.
II. A quantidade de CO necessários para produzir 7 mol de ferro é 10,5 mol.
III. A massa de gás carbônico obtida partindo-se de 20 kg de óxido de ferro III será 16,5 g.
IV. A quantidade de monóxido de carbono necessária para reagir com 600 g de óxido férrico é 11,25 mol.
V. O volume de CO, medidos nas CNTP, consumido na obtenção de 60 kg de ferro será ~3,6 104 L.
Após analisar as afirmativas de I a V, assinale a
alternativa correta:
NH3 (g) + O2 (g) → NO (g) + H2O (L)
O quadro a seguir apresenta os valores da entalpia-padrão de formação e da entropia molar dos compostos NH3 , NO, O2 e H2O, respectivamente.
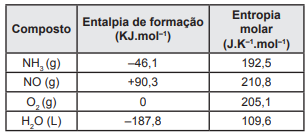 A partir dessas informações, assinale a alternativa
INCORRETA.
A partir dessas informações, assinale a alternativa
INCORRETA.MnO4- (aq) + Fe2+(aq) + H+(aq) → Fe3+(aq) + Mn2+(aq) + H2O(l)