Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
C5H12 (g) + 8 O2 (g) → 5 CO2 (g) + 6 H2O (g),
em que todos os gases estão nas mesmas condições de pressão e temperatura. Com base nessas informações, assinale a opção que corresponde ao volume de oxigênio necessário para produzir 60 m3 de gás carbônico.

Assinale a opção que apresenta o número do processo em que todas as reações estão corretas, no que diz respeito ao balanceamento e aos produtos formados.
(Usberco & Salvador in Química Geral)
Em todas as reações químicas, as substâncias denominadas reagentes são transformadas em substâncias diferentes, denominadas produtos. Tais reações são representadas por equações químicas devidamente balanceadas, nas quais a quantidade de átomos de cada elemento participante deve ser igual nos reagentes e nos produtos.
As equações I, II e III a seguir não estão balanceadas:
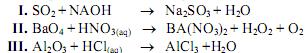
Após o devido balanceamento estequiométrico das mesmas, a sequência correta, respectivamente em I, II e III, dos coeficientes dos reagentes e produtos necessários será:
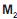 O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.
O e MO. Considere as afirmações abaixo sobre esse elemento e seus compostos.I - O elemento M pertence ao grupo dos metais alcali- nos.
II - No composto MO, o oxigênio apresenta estado de oxidação -1.
III - O elemento M apresenta dois estados de oxidação.
IV - No composto
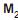 O, o oxigênio apresenta estado de oxidação -2.
O, o oxigênio apresenta estado de oxidação -2.São corretas APENAS as afirmativas
Um exemplo de danos materiais (e também culturais) causado pela chuva ácida ocorre na Grécia, onde diversos monumentos históricos feitos de mármore foram danificados, forçando o governo a trocar algumas esculturas por réplicas. Os principais agentes da chuva ácida são óxidos do nitrogênio e do enxofre. Considere que 3,20 g de enxofre foram queimados em excesso de gás oxigênio, originando o óxido onde o enxofre se encontra em seu maior estado de oxidação. Tal óxido foi recolhido em quantidade suficiente de água em um erlenmeyer onde foi introduzido um pedaço de mármore de 10,00 g. Se todas as etapas do processo apresentam rendimento de 100 %, e apenas 80,0 % do mármore é formado por carbonato de cálcio, ao final da última reação, a massa de gás liberada, em g, foi de
O buraco na camada de ozônio era causado por gases conhecidos como CFC’s, os cloro-flúor-carbonos, que interferiam no equilíbrio existente entre o gás oxigênio e o ozônio. Analise as afirmações abaixo sobre o ozônio e o oxigênio.
I - A hibridação do oxigênio central do ozônio é sp2 e a geometria molecular é angular.
II - O ozônio e o gás oxigênio por serem formados pelo mesmo elemento, são isômeros.
III - As ligações entre os oxigênios são mais fracas no ozônio que no gás oxigênio.
IV - O ozônio e o gás oxigênio são conhecidos pelo forte caráter redutor.
Estão corretas as afirmativas
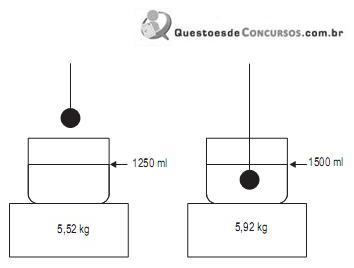
Nesse caso, a densidade do líquido, determinada corretamente pelo laboratorista, em g/cm3 , é
I – foram pesados 2,22 g de cloreto de cálcio;
II – a massa do sal foi dissolvida em 200 ml de água em um béquer;
III – transferiu-se o conteúdo do béquer para um cilindro graduado, onde se adicionou água até que o volume de solução fosse de 500 ml.
Se 100 ml da solução de cloreto de cálcio foi misturada a 100 ml de uma solução aquosa de cloreto de sódio 5,85 g/L, a concentração de íons cloreto, em mol/L, na mistura, é de
2KO2(s) + CO2(g) ? K2CO3(s) + 3/2 O2(g)
Se uma pessoa exala cerca de 1020,0 L de gás carbônico por dia, a quantidade de superóxido necessária para capturar todo o gás carbônico num período de três dias de viagem, em kg, é
Dado: Densidade do gás carbônico = 1,960 g/L