Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.455 questões

Considerando-se que o grau de dissociação do
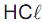 é de 30% e que no equilíbrio existe 1,4 mol de
é de 30% e que no equilíbrio existe 1,4 mol de 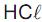 , qual o valor de n?
, qual o valor de n?Considere a reação abaixo, onde íons permanganato reagem com ácido oxálico, em solução aquosa ácida, produzindo íons manganês II, dióxido de carbono e água.
2MnO4– (aq) + 5H2C2O4(aq) + 6H+(aq) → 2Mn+2(aq) + 8H2O(l) + 10CO2(g)
A partir do processo descrito, conclui-se que
Disponível em: http://www.estadao.com.br
Acesso em: 02 dez. 2010.
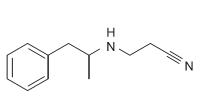
O femproporex, cuja estrutura está representada acima,
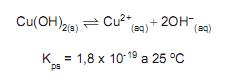
Sendo o valor do pH ideal da água da piscina igual a 6, a quantidade máxima de CuSO4 . 5H2 O em massa, que deve ser adicionada a uma piscina de volume igual a 10.000 L, com água no pH ideal, em kg, é
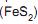 , galena (PbS) esílica(SiO2) , além de outros minerais, e possui a seguinte composição: 50% de Zn, 32% de S, 8% de Fe, 1% de Si, 0,2% de Cd. O tratamento envolve ustulação, lixiviação do zinco, purificação da solução e eletrorredução do metal, com a obtenção de ácido sulfúrico como subproduto. Que quantidade, em kg, de ácido sulfúrico 98% é obtida para cada tonelada de zinco produzido?
, galena (PbS) esílica(SiO2) , além de outros minerais, e possui a seguinte composição: 50% de Zn, 32% de S, 8% de Fe, 1% de Si, 0,2% de Cd. O tratamento envolve ustulação, lixiviação do zinco, purificação da solução e eletrorredução do metal, com a obtenção de ácido sulfúrico como subproduto. Que quantidade, em kg, de ácido sulfúrico 98% é obtida para cada tonelada de zinco produzido?
Qual o volume, em mililitros, da solução de NaOH gasto na titulação?
- o produto precipitado deve ser suficientemente insolúvel para que não ocorram perdas na filtração e lavagem;
- a natureza física do precipitado deve ser tal que permita ser separado da solução por filtração e possa ser lavado até ficar livre de impurezas solúveis;
- o produto precipitado deve ser conversível em uma substância pura de composição química;
- o agente precipitante não deve ser reativo com os constituintes da atmosfera.
Considerando que o produto de solubilidade do AgCl, em água pura, seja 1,6 x 10-10 (Kps a 25 °C) e que a solubilidade do AgCl seja 1,3 x 10-5 mol/L, qual seria a solubilidade de Ag+ em uma solução de NaCl 0,10 M?
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
II - Pelo fato de o valor do
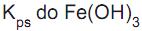 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido. III - O
 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz. IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em
A H2SO4 + B NaOH → C Na2SO4 + D H2O, tem-se A + B + C + D = 6. Nessas condições, B + D é igual a
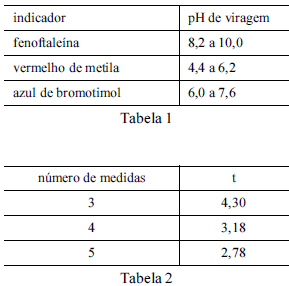
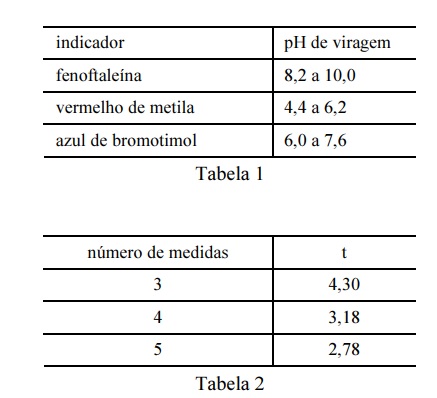
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes
Entre os indicadores apresentados na tabela 1, o mais
adequado à titulação em questão é o vermelho de metila.
Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%.
Com base nessas informações, julgue os itens seguintes.
Considerando-se a inexistência de erros sistemáticos, é correto afirmar que a probabilidade de que o valor real da concentração de NaOH esteja no intervalo compreendido entre 0,078 e 0,082 será maior que 95%.

Considere que uma solução de NaOH foi padronizada por meio da titulação, em quadruplicata, com 20,00 mL de uma solução padrão de biftalato de potássio 0,1000 mol/L e que a concentração média encontrada para a solução de NaOH foi de 0,080 mol/L, com uma estimativa do desvio padrão de ±0,002 mol/L. Considere, ainda, a tabela 1, em que é apresentado o pH de viragem de alguns indicadores ácido-base, e a tabela 2, em que são apresentados os valores do parâmetro t de student para uma probabilidade de 95%. Com base nessas informações, julgue os itens seguintes.
A partir dos resultados obtidos, pode-se inferir que o volume
médio da solução de NaOH gasto na titulação é maior que
22,0 mL.
Preparou-se 100 mL de uma solução padrão de biftalato de potássio, de acordo com o seguinte procedimento: (i) pesagem de um béquer vazio em uma balança analítica; (ii) pesagem do béquer contendo 2,0000 g do biftalato na mesma balança; (iii) dissolução do biftalato, por meio da adição de água suficiente ao béquer; (iv) transferência de todo o conteúdo do béquer para um balão volumétrico de 100,00 mL; (v) preenchimento do balão com água até o menisco.
Considerando as informações acima e que os desvios padrão sejam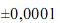 g, para uma simples leitura na balança utilizada, e
g, para uma simples leitura na balança utilizada, e 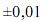 mL, para uma leitura de menisco no balão, julgue o próximo item.
mL, para uma leitura de menisco no balão, julgue o próximo item.
O desvio padrão relativo para a concentração da solução de biftalato de potássio preparada é maior que 1,0×10-4 .
Considerando as informações acima e que os desvios padrão sejam
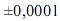 g, para uma simples leitura na balança utilizada,
g, para uma simples leitura na balança utilizada,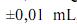 e , para uma leitura de menisco no balão, julgue os próximos itens.
e , para uma leitura de menisco no balão, julgue os próximos itens.Caso a solução de biftalato preparada seja usada, posteriormente, na padronização de uma solução básica, a presença de impurezas no biftalato usado para a preparação de sua solução gerará um erro aleatório que, consequentemente, afetará a precisão dos resultados obtidos durante a padronização.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
De acordo com a nomenclatura sistemática, o composto
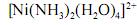 denomina-se diamintetraaquoniquelato.
denomina-se diamintetraaquoniquelato. 