Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões
Qual é, aproximadamente, o volume, em L, ocupado por essa massa de 13 kg?
Dado: R = 0,082 atm.L.mol -1 .K-1
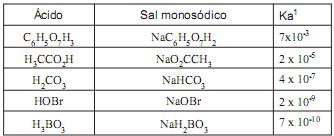
Com base nos valores da constante de equilíbrio da primeira dissociação ácida em meio aquoso (Ka1 ) dos ácidos listados, um dos pares ácido/ sal monosódico foi escolhido para a preparação da solução tampão. Desta forma, massa correspondente a 0,16 mol do sal monosódico foi pesada e transferida quantitativamente para um balão volumétrico de 1 litro. Para se obter 1 litro da solução tampão desejada, a massa do ácido pesada e transferida quantitativamente para o balão volumétrico contendo o sal monosódico deve ser
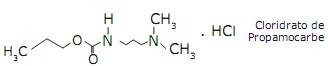
A massa do sal Cloridrato de Propamocarbe necessária para preparar 10 L de uma solução do Propamocarbe na sua forma de Base Livre com concentração 0,1 mol/L é
Se a temperatura da mistura é de 27 °C, a pressão, em atm, é, aproximadamente, de
Dados: Constante universal dos gases R = 0,082 L.atm.K−1 .mol−1 Peso atômico do hidrogênio = 1 Peso atômico do oxigênio = 16 Peso atômico do nitrogênio = 14
Um químico dispõe de duas soluções estoque de NaC, uma de 1,7 mol/L (solução I) e outra de título 25% e densidade 2 g/mL (solução II), para preparar 500 mL da solução de cloreto de sódio 10% p/v.
Os volumes das soluções I e II para o preparo da solução desejada, quando usados separadamente são, respectivamente,
Dado:1 mol de NaCl corresponde a 58, 5 g de Nacl
Fe (s) + O2 + H2 O (vapor) → Fe(OH)2 Fe(OH)2 + O2 (g) → Fe2 O3 H2 O (vermelha ou castanha) + H2 O
Fe(OH)2 → Fe3 O4 (preto)+H2 O +H2 Nas reações descritas pelas equações acima, observa-se que o ferro
O volume molar do vapor de iodo a 309 K é superior a 8,0 m3 • mol–1
Supondo-se que tivessem sido injetados no condenado 50 mL de uma solução letal com concentração de KCl igual a 1,6 mol•L–1 , é correto afirmar que a massa de sal injetada equivaleria a 6,0 g.
A massa de óxido de cálcio, em kg, e o volume de dióxido de carbono, em L, medidos nas condições normais de temperatura e pressão, produzidos pela pirólise de uma tonelada de carbonato com um grau de pureza de 50%, são, respectivamente, iguais a
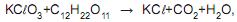 a quantidade, em gramas, de cloreto de potássio formada quando reagem 2,0 mols de
a quantidade, em gramas, de cloreto de potássio formada quando reagem 2,0 mols de 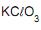 é de, aproximadamente,
é de, aproximadamente,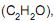 o volume de dióxido de carbono gasoso produzido, nas condições normais de temperatura e pressão, quando 126,0 gramas de etileno reagem com excesso de oxigênio, em L, é igual a
o volume de dióxido de carbono gasoso produzido, nas condições normais de temperatura e pressão, quando 126,0 gramas de etileno reagem com excesso de oxigênio, em L, é igual aPb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2NaNO3(aq)
A quantidade máxima de sulfato de chumbo II que pode ser obtida a partir da reação de 6,62 g de Pb(NO3)2 com Na2SO4 em excesso é, aproximadamente, em g, igual a Dados: M(Pb(NO3)2) = 331 g/mol M(PbSO4) = 303 g/mol
MnO4 - + H2C2O4 + H+ → Mn2+ + CO2 + H2O
Após o correto balanceamento da reação redox descrita, a soma dos coeficientes estequiométricos na equação será igual a
A 25,00 mL dessa solução adicionou-se, lentamente e com agitação constante, uma solução aquosa de hidróxido de amônio até a precipitação completa de hidróxido de Fe III (Reação I).
Fe3+ (aq)+ 3 OH - (aq) → Fe(OH) 3(s) Reação I
Após envelhecimento do precipitado em sua água-mãe, procedeu-se à filtração e à lavagem do precipitado. O precipitado foi transferido para um cadinho previamente tarado, onde foi feita a sua calcinação (Reação II).
2Fe(OH) 3(s) → Fe2 O 3(s) + 3H2 O(g) Reação II
Sendo a massa de Fe2 O3(s)obtida após a calcinação, igual a 0,40 g, qual a concentração de Fe 3+ na solução original, em g/L?
Dados:
massa molar do Fe = 56 g/mol
massa molar do Fe2 O3 = 160 g/mol
Na2 SO4(aq)+ BaCl 2(aq)→ BaSO 4(s)+ 2NaCl (aq)
A quantidade máxima de sulfato de bário que se forma é, aproximadamente, de
A porcentagem de CaCO3 presente nesse calcário é

