Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.455 questões
6Fe2+(aq) + Cr2O72-(aq) + 14H+(aq) ? 6Fe3+(aq) + 2Cr3+(aq) + 7H2O(L)
Qual é a percentagem em massa de ferro na amostra?
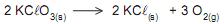
Sendo o volume molar igual 22,4 L/mol (na condição normal de temperatura e pressão), o volume máximo de oxigênio que pode ser obtido a partir da decomposição de 4,00 mol de KCLO3 , com o rendimento percentual de 90%, em L, é
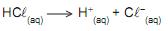
O volume, em mL, de solução aquosa de HCL0,1 mol/L necessário para o preparo de 1 L de solução com pH = 3 é
No meio aquoso, esses dois sais reagem instantaneamente, de acordo com a equação balanceada abaixo, e nela se forma um sal muito pouco solúvel.

A quantidade máxima, em gramas, de AgCL sólido (massa molar = 143,5 g/mol e Kps = 10-10 ) que se forma é de, aproximadamente,

Se, no frasco Erlenmeyer, há 25,00 mL de HCL(aq) 0,200 mol/L, o volume de NaOH(aq) 0,100 mol/L que deve escoar da bureta, em mL, até se atingir o ponto estequiométrico, é

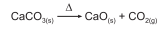
A quantidade máxima, em kg, de óxido de cálcio que se obtém a partir de 200 kg de calcário, contendo 90% em massa de carbonato de cálcio, é
Considere a hipótese de reação, unicamente na direção do produto, entre 5 mol de nitrogênio gasoso e quantidade suficiente de hidrogênio gasoso para o consumo total do N2 e formação de gás amoníaco, conforme a equação a seguir.
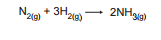
O volume máximo de NH3(g) , em litros, a ser obtido na CNTP é

A charge faz uma critica às exigências de controle de qualidade para a certificação em produtos. Nessa perspectiva, considere que a massa desse projétil é 1,5 g. Logo, a massa de prata presente, em gramas, é aproximadamente
Fe + O2 + H2O → Fe2+ + (OH)- → Fe(OH)2
Fe (OH)2 + O2 + H2O → Fe (OH)3
Sabe-se que, para um gás ideal, 1 mol equivale a 6,02 x 1023 moléculas e 22,4 L nas CNTP. Após realizar o correto balanço das equações desse processo corrosivo, conclui-se que, para produzir 10 mols de Fe (OH)3, nas CNTP, é necessário consumir
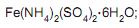 adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de
adição de gotas de solução 0,1 mol/L de permanganato de potássio (KMnO4 ) até persistir uma leve coloração rosa; transferência da solução resultante para um balão de 250,00 mL e acréscimo de água deionizada até o traço de aferição. A massa de 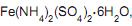 em gramas, utilizada nesse procedimento, foi de
em gramas, utilizada nesse procedimento, foi deA percentagem de carbonato de cálcio, na amostra de calcário, considerando-se que, nas condições do experimento, o volume molar dos gases é de 25,0 L/mol e as impurezas presentes são inertes, é
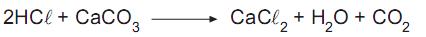
Qual a massa, em gramas, de água que é produzida na reação do ácido clorídrico com 50 g de carbonato de cálcio, conforme o processo químico mostrado acima?
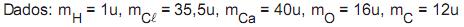

Na reação de oxidação do ferro, mostrada acima, equilibrando-se corretamente a reação no lado esquerdo, qual o número de mols de oxigênio
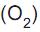 necessário para reagir completamente com uma amostra que contenha 16 mols de Ferro (Fe)?
necessário para reagir completamente com uma amostra que contenha 16 mols de Ferro (Fe)?