Questões de Concurso
Sobre representação das transformações químicas em química
Foram encontradas 1.497 questões

Para identificação de um óxido de nitrogênio desconhecido foram analisadas, por meio da decomposição, três amostras dessa substância química. Os dados obtidos durante a análise foram organizados de acordo com a tabela.
Uma análise dessas informações e dos dados da tabela
permite concluir:
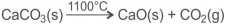
O calcário é um minério que contém carbonato de cálcio, CaCO3. É utilizado na agricultura para corrigir o pH do solo e na produção de cal, CaO, destinada à indústria siderúrgica, de cimento, de vidro e de alvejantes.
Uma amostra de 30,0g de calcário foi calcinada a 1100ºC e liberou 6,0L de dióxido de carbono, CO2(g), medidos a 30ºC e 1,0atm.
A partir dessas informações sobre a calcinação da amostra de calcário, é correto afirmar:
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
Caso a solução tampão mencionada, com pH = 7,2, tenha sido
preparada pelo técnico, é correto afirmar que ela possui uma
capacidade tamponante maior para pequenas adições de base
do que para pequenas adições de ácido.
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
A partir das soluções descritas no texto, é possível o preparo
de uma solução tampão que seja adequada para tamponar um
sistema em pH = 11.
Um técnico de laboratório necessita preparar 500 mL de uma solução tampão de pH = 7,2, em que a soma das concentrações do ácido e de sua base conjugada deva ser 0,100 mol  L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol
L-1 . Para isso, o técnico tem à sua disposição as soluções de ácido fosfórico (H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração 0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
L-1. Considerando essa situação e as informações apresentadas, julgue o item a seguir, com relação a preparo, aplicação e equilíbrios químicos envolvidos em soluções tampões.
Para o preparo da referida solução tampão, serão necessários
100 mL de ácido fosfórico e mais de 70 mL de hidróxido de
sódio.
Um técnico de laboratório necessita preparar 500 mL de uma
solução tampão de pH = 7,2, em que a soma das concentrações do
ácido e de sua base conjugada deva ser 0,100 mol  L-1
. Para isso,
o técnico tem à sua disposição as soluções de ácido fosfórico
(H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração
0,500 mol
L-1
. Para isso,
o técnico tem à sua disposição as soluções de ácido fosfórico
(H3PO4; pKa1 = 2,12; pKa2 = 7,20; e pKa3 = 12,67) de concentração
0,500 mol  L-1 e NaOH 1,00 mol
L-1 e NaOH 1,00 mol  L-1. Considerando essa situação
e as informações apresentadas, julgue o item a seguir, com relação
a preparo, aplicação e equilíbrios químicos envolvidos em soluções
tampões.
L-1. Considerando essa situação
e as informações apresentadas, julgue o item a seguir, com relação
a preparo, aplicação e equilíbrios químicos envolvidos em soluções
tampões.
Considere que o tampão tenha sido preparado pelo técnico e
utilizado para tamponar uma reação que produziu
2,0 × 10-2 mol de H+ após 2 horas de reação. Em face dessa
situação, é correto concluir que o tampão continua ativo e
trabalhando dentro da sua faixa de uso.
O teor de H2O2 em um frasco de peróxido de hidrogênio P.A. foi determinado a partir de uma alíquota de 5,00 mL de amostra. Foram adicionados a essa amostra 1,00 mL de H2SO4 e de água destilada até a obtenção de 50 mL de volume total. Posteriormente, foi realizada uma titulação com solução padrão de KMnO4 de concentração igual a 0,40 mol/L, de acordo com a seguinte reação não balanceada abaixo.
MnO4- + H2O2 → Mn2+ + O2
Tendo como base as informações acima, sabendo que foram gastos 40,00 mL de KMnO4 na titulação da amostra e que a concentração esperada de H2O2 para o reagente é de 30 % (massa/volume), ou seja, gramas por 100 mL, julgue o próximo item.
O teor de peróxido de hidrogênio no frasco é igual a 20,2 %
(massa/volume).
O teor de H2O2 em um frasco de peróxido de hidrogênio P.A. foi determinado a partir de uma alíquota de 5,00 mL de amostra. Foram adicionados a essa amostra 1,00 mL de H2SO4 e de água destilada até a obtenção de 50 mL de volume total. Posteriormente, foi realizada uma titulação com solução padrão de KMnO4 de concentração igual a 0,40 mol/L, de acordo com a seguinte reação não balanceada abaixo.
MnO4- + H2O2 → Mn2+ + O2
Tendo como base as informações acima, sabendo que foram gastos 40,00 mL de KMnO4 na titulação da amostra e que a concentração esperada de H2O2 para o reagente é de 30 % (massa/volume), ou seja, gramas por 100 mL, julgue o próximo item.
A precisão de um método volumétrico pode ser confirmada
pela comparação do resultado obtido na análise de uma
amostra de referência com teor conhecido ou pela comparação
dos resultados com outro método analítico bem estabelecido.
O teor de H2O2 em um frasco de peróxido de hidrogênio P.A. foi determinado a partir de uma alíquota de 5,00 mL de amostra. Foram adicionados a essa amostra 1,00 mL de H2SO4 e de água destilada até a obtenção de 50 mL de volume total. Posteriormente, foi realizada uma titulação com solução padrão de KMnO4 de concentração igual a 0,40 mol/L, de acordo com a seguinte reação não balanceada abaixo.
MnO4- + H2O2 → Mn2+ + O2
Tendo como base as informações acima, sabendo que foram gastos 40,00 mL de KMnO4 na titulação da amostra e que a concentração esperada de H2O2 para o reagente é de 30 % (massa/volume), ou seja, gramas por 100 mL, julgue o próximo item.
A solução de KMnO4 não requer padronização por ser
considerada um padrão primário.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
A adição da solução de MgEDTA é necessária para complexar
interferentes presentes na amostra e, assim, determinar
precisamente a quantidade de cálcio.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
Titulações de complexação com EDTA devem ser realizadas
com pH controlado, preferencialmente pH ácido, para evitar a
formação de hidróxidos dos metais de interesse.
O teor de cálcio em uma amostra de água de rejeito industrial foi determinado por volumetria de complexação. Na análise, transferiram-se para um erlenmeyer 5,00 mL da amostra, 5,00 mL de solução tampão, 10,00 mL de uma solução de complexo magnésio-EDTA e uma ponta de espátula de negro de eriocromo. Em seguida, procedeu-se a titulação com 38,0 mL de uma solução padrão de EDTA 0,01 mol/L. Considerando essas informações, julgue o item subsequente, com relação à análise de cálcio na água descrita acima, à volumetria e aos equilíbrios de complexação.
O teor de cálcio da referida amostra é superior a 3,0 g/L.
Uma das características mais importantes da água de um aquário é o pH. O pH resumidamente é um índice que mostra quão ácida ou alcalina está a água ou se ela está neutra. (...) O ideal antes de se montar um aquário é determinar qual o tipo de peixe que você pretende ter vivendo nele e por meio de uma tabela de pHs dos referidos peixes você saberá se os peixes são compatíveis e em consequência qual o pH que sua água deverá ter. Com isso concluímos que não podemos misturar indiscriminadamente peixes de espécies diferentes. Existem peixes que têm como pH ideal 7.2 (é o caso do Kinguio) e outros como o Neon que preferem pH ácido (abaixo de 7). Não adianta misturar os dois pois a água nunca vai ficar ideal para ambos.
(Fonte: Aquarismo. http://www.aquarismo.com.br)
Em um aquário que apresentou uma basicidade acima do limite
permitido para a vida de determinados peixes há necessidade de
correção dessa água. Teoricamente essa correção poderia ser
realizada adicionando-se
Trinitrato de glicerina (TNG) também denominado nitroglicerina, é o éster trinitrado do propanotriol (...) O TNG é um líquido oleoso, insolúvel em água e extremamente sensível, não apenas à temperatura, mas também ao choque mecânico, motivo pelo qual deve ser manuseado com extremo cuidado. Sua combustão ao ar gera CO2, N2, O2, H2O.
(FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010.)
A combustão completa de 1 mol de TNG (Massa molecular=227g)
produz um volume de gás carbônico nas Condições Normais de
Temperatura e Pressão de
A pólvora negra, ainda utilizada em muitos cartuchos, tem a seguinte composição aproximada : 75% salitre, 13% carvão vegetal e 12% enxofre(...) quando do disparo de arma de fogo, essa mistura termina por gerar dentre os resíduos sólidos: sulfatos (…).
(Fonte: FARIAS,R.F. Introdução à Química Forense .3ª edição. Campina, SP: Editora Átomo, 2010.)
Uma amosta de 100 gramas de pólvora negra poderá gerar uma massa, em gramas, de sulfato de sódio de, no máximo,
Dados:
massa molecular de Na2SO4 = 142u
massa atômica do S = 32 u
Valores dos pesos atômicos dos elementos:
Valores dos pesos atômicos dos elementos:
Elemento -------- Peso atômico (g/mol)
Carbono --------- 12,011
Hidrogênio ------ 1,008
Oxigênio -------- 15,999
CH4 + 202 - > CO2 + 2H2O