Questões de Concurso
Comentadas sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 186 questões
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
[Dados: massas molares (em g.mol-1). Metano: 16; Amônia: 17.]
Nesse caso, é correto afirmar que os recipientes contêm
- O gás é formado por moléculas que se encontram em movimento desordenado e permanente. Cada molécula pode ter velocidade diferente das demais. - Cada molécula do gás interage com as outras somente por meio de colisões (forças normais de contato). A única energia das moléculas é a energia cinética. - Todas as colisões entre as moléculas e as paredes do recipiente que contém o gás são perfeitamente elásticas. A energia cinética total se conserva, mas a velocidade de cada molécula pode mudar. - As moléculas são infinitamente pequenas. A maior parte do volume ocupado por um gás é espaço vazio.
Seguindo estes quatro postulados, Boltzmann e Maxwell mostraram a relação entre a energia cinética média do total de moléculas de um gás ideal e sua temperatura conforme a expressão:
PV = 2/3 N { ½ m[v 2 ]} ½ m[v 2 ] = 3/2 kT Onde: N = número de moléculas; k (constante de Boltzmann) = 1,38.10 -23 J/K; T = temperatura absoluta (Kelvin)
Considere que o gás seja ideal, mantido em um recipiente isolado e fechado hermeticamente, e assinale a alternativa correta de acordo com a teoria cinética dos gases.
Adaptado. Oxigênio Hospitalar (mixandi.com.br). Acesso em 24 de Julho de 2021.
Considere a seguinte situação hipotética. Temos em um hospital, um cilindro contendo gás oxigênio hospitalar com volume de 15 m3 , mantido à temperatura de -23 ℃ e à pressão de 25 atm. Assinale a alternativa que apresenta a quantidade, em mols, e a massa, em quilogramas (Kg), de O2 que estão contidas neste cilindro. Considere o O2 um gás ideal. Dados: R = 0,082 atm.L.K-1 .mol-1 ; M.M do gás O2 (g/mol) = 32.
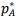 = 12 kPa e de B é
= 12 kPa e de B é 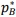 = 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta.
= 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta. A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Um gás real comporta-se como um gás ideal quando
submetido à alta pressão e à alta temperatura.
A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Considerando-se que um número de moléculas n de um
gás ideal ocupe um volume de 10 m3
, a certa
temperatura e pressão, é correto afirmar que, caso a sua
pressão inicial seja reduzida pela metade e a
temperatura inicial dobre, o novo volume ocupado por
esse gás, em L, será de 4.104
.

I A pressão parcial do CO (g), a qualquer momento, será igual à pressão parcial do CH4 (g).
II A pressão total, a qualquer momento, corresponde à média entre as pressões parciais de cada gás presente no sistema.
III A pressão parcial do H2 (g) será sempre superior à do CO (g).
Assinale a opção correta.
Dados: H=1, C=12, O=16; R= 0,082 L.atm/mol.K T(K)= T(°C) + 273

Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
A equação de Clapeyron pode ser utilizada para gases reais,
desde que seja inserido fator de compressibilidade.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
Um gás cuja densidade seja de 1,26 g/L à temperatura de
50 ℃ e à pressão de 747 mmHg tem massa molar inferior a
35 g/mol.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
Nas condições normais de temperatura e pressão (CNTP),
180 g de água no estado de vapor ocupam um volume de
224 L.
Acerca de gases, julgue o item seguinte, considerando que o volume molar valha 22,4 L, que a constante universal dos gases perfeitos valha 62,4 L · mmHg · K−1 · mol−1 e que MH = 1 g/mol e MO = 16 g/mol.
A relação entre pressão e volume é norteada pela lei de
Avogadro.
Acerca de equilíbrio químico, julgue o item subsequente.
A equação de Van Del Waals oferece uma descrição
quantitativa da constante de equilíbrio em dada temperatura.
O gráfico que melhor representa a variação de entalpia (H) em função da pressão (P) neste processo é:
Na figura a seguir é esboçado o gráfico do fator de compressibilidade dos gases genéricos A e B, em função da pressão, sob temperatura ambiente.
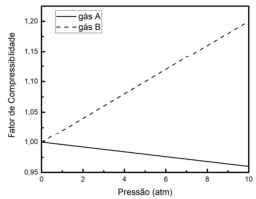
Em relação ao gás A, sob temperatura ambiente e na faixa de
pressões mostrada, o gás B apresenta