Questões de Concurso
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 491 questões
( ) A soma de pH+pOH resultará sempre igual a 14. Sendo assim, se o pH de uma solução for 3,2, seu pOH será 10,8, e vice-versa.
( ) Soluções básicas apresentam a concentração de íons H3O+ superior à concentração de íons OH- (pH>7).
( ) Uma solução apresenta concentração hidrogeniônica de 10-4 mol/L, ou seja, pH = 4.
( ) Soluções ácidas apresentam a concentração de íons H3O+ superior à concentração de íons OH- (pH>7).
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Considere os dados da tabela abaixo:

De acordo com os dados acima, o ânion que atua como base mais forte é:
Dados: log 2 = 0,3 e log 3 = 0,48
Dado: log 3 = 0,48
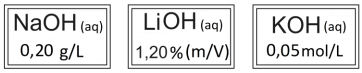
Considerando que todas as bases têm 100% de dissociação iônica e que o técnico precisa organizar as garrafas em ordem decrescente dos valores de pH, assinale a alternativa que indica a ordem correta das garrafas.
Massas molares em g/mol: H = 1; O = 16; Li = 7; Na = 23; K = 39
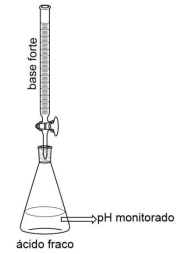
Uma solução tampão é uma solução que
Assinale a alternativa que indique corretamente a relação entre o pH e a concentração de íons H+ em uma solução.
Em uma indústria produtora de óleo vegetal de soja, situada no Estado da Bahia, um analista, durante o turno A, preparou uma solução de forma errônea, não seguindo o procedimento operacional padrão. Durante o Turno B, um outro analista utilizou a solução preparada no turno A para determinar o Teor de Alcalinidade Combinada presente no óleo da produção, mas os valores foram acima dos aceitáveis para o controle de qualidade de rotina hora a hora. O responsável pela produção dirigiu-se até ao laboratório para entender mais sobre o resultado obtido, antes de modificar algum procedimento na produção. O texto externa algo sobre um erro ocorrido durante a realização de uma técnica muito comum em laboratórios que trabalham com óleos vegetais.
A esse respeito assinale a alternativa correta que corresponde a essa técnica.
Um pesquisador solicitou a um técnico que preparasse soluções de sais de sódio utilizando os ácidos listados na tabela a seguir com uma concentração inicial de 0,500 M.
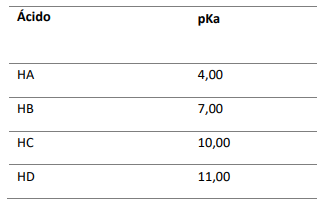
Nessa situação, a solução que terá o pH mais alto e será a mais básica é(são)
A titulação de um ácido forte e uma base fraca pode ser ilustrado pela reação do HCl e NH₄OH, conforme representada abaixo:
HCl + NH₄OH ⇄ NH₄Cl + H₂O
Assinale a alternativa que apresente corretamente o indicador mais apropriado para a titulação.
Qual é um indicador de pH comumente utilizado em titulações ácido-base que muda de cor na faixa de pH adequada para essa titulação?
Uma amostra de uma solução desconhecida foi analisada e os seguintes dados foram obtidos: concentração de íons H+ = 1 x 10-4 M e concentração de íons OH- =1 x 10-10. Com base nesses dados, qual das seguintes conclusões é mais adequada?
Uma empresa de vinagre teve seus produtos adulterados com ácido clorídrico. Para determinar a concentração do ácido clorídrico na amostra de vinagre adulterado, utilizando potenciometria, um analista titulou a amostra com hidróxido de sódio. A partir do que se observa durante a titulação potenciométrica da mistura dos ácidos, analise as assertivas a seguir e assinale V, se verdadeiras, ou F, se falsas.
( ) Na mistura de ácidos, titula-se primeiro o ácido fraco, ácido acético, e depois o ácido forte, ácido clorídrico.
( ) No início da titulação, a concentração de ácido acético está reprimida e não é analisada.
( ) Uma maneira de obter os volumes de titulante gasto para a titulação potenciométrica da mistura é utilizar a 1ª e 2ª derivadas da curva potenciométrica.
( ) É possível determinar cada um dos componentes de uma mistura contendo um ácido forte e um fraco, desde que a constante de dissociação do ácido fraco seja algo maior que 10-4 e que as concentrações dos dois tenham uma diferença de até duas ordens de grandeza.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Considere a reação entre 10 mL de NH3 (0,01 mol/L) e 20 mL de HCl. Qual é o valor da concentração de íons H+ na solução? Dados Ka NH4+: 5,7.10-10.
A análise das características químicas da água é essencial para garantir sua qualidade em aplicações laboratoriais. Considerando parâmetros como acidez, pH, alcalinidade, alumínio, ferro e manganês, cloretos, fluoreto, sulfetos e sulfatos, sólidos dissolvidos, sólidos em suspensão, nitritos e nitratos, qual das alternativas a seguir descreve corretamente o impacto dessas características na qualidade da água?
Em uma titulação ácido-base, qual dos seguintes fatores é mais crucial para garantir a precisão e a exatidão dos resultados obtidos?
A preparação correta de soluções, tampões, indicadores e padrões é essencial para garantir a precisão das análises laboratoriais. Sobre o assunto, analise as assertivas a seguir e assinale V, se verdadeiras, ou F, se falsas.
( ) Um padrão primário deve ser altamente solúvel em água, estável e ter uma pureza elevada.
( ) Soluções tampão são preparadas utilizando pares ácido-base conjugados e são utilizadas para manter o pH constante em um intervalo específico.
( ) Soluções tampão são utilizadas para manter o pH constante, mas são ineficazes quando pequenas quantidades de ácido ou base são adicionadas.
( ) Indicadores são substâncias que mudam de cor em resposta a alterações no pH e são usados para identificar pontos de equivalência em titulações ácido-base.
( ) A concentração de uma solução padrão não precisa ser conhecida com alta precisão, pois pequenos erros não afetam os resultados analíticos.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Foi solicitado auxílio a um laboratorista para o desenvolvimento de um método analítico relacionado à análise de alguns analitos em recursos hídricos. Sabendo-se que a amostragem é uma importante etapa de desenvolvimento de métodos analíticos, é CORRETO afirmar que:
A padronização ácido-base é um procedimento essencial em laboratórios químicos para determinar a concentração exata de uma solução ácida ou básica. Um exemplo comum desse processo envolve a padronização do ácido clorídrico (HCl) e do hidróxido de sódio (NaOH). Inicialmente, uma solução de concentração conhecida de NaOH é utilizada para neutralizar uma solução de HCl, com o auxílio de um indicador apropriado, como a fenolftaleína. A partir da quantidade de NaOH consumida para neutralizar o HCl, é possível calcular a concentração exata do ácido clorídrico. A padronização ácido-base com HCl e NaOH é crucial para garantir a precisão e confiabilidade das análises químicas que dependem dessas soluções.
Suponha que você tenha um NaOH 0,25 molar e gastou 6 mL para titular o HCl com concentração de 0,1 molar. Qual o volume de HCl que continha no Erlenmeyer? Assinale a alternativa CORRETA.