Questões de Concurso
Comentadas sobre sistemas homogêneos: solubilidade dos sais, hidrólise dos sais e curvas de titulação. em química
Foram encontradas 135 questões
A figura a seguir apresenta duas curvas quase que sobrepostas, correspondentes ao mesmo procedimento: a curva de titulação entre um fármaco ácido e NaOH e a curva obtida quando se tira a 1ª derivada da curva de titulação. Analise as afirmações e escreva V para verdadeiro ou F para falso:
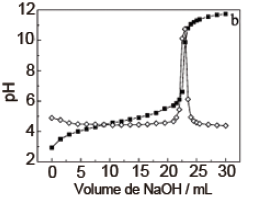
( ) A titulação envolve ácido fraco e base forte, se não fosse potenciométrica a utilização de fenolftaleína como indicador, teria preferência a utilização de alaranjado de metila.
( ) O p.e. (ponto de equivalência) será em pH igual 7.
( ) o pKa do titulado é próximo a 5.
( ) A derivada da curva tem por finalidade indicar o volume gasto até o p.e. para a neutralização.
( ) O sitema atua como um tampão na faixa 4<pH<5,5.
Assinale a alternativa correta quanto ao verdadeiro ou falso:
Uma amostra de 50 mL de água contendo cátions Fe3+ foi tratada com excesso de NH4OH. O precipitado obtido depois de lavado, secado e calcinado pesou 0,320 g. A quantidade de ferro, em mol/L presente na amostra é
Dados:
Massas molares em g/mol
Fe = 56
O = 16
H = 1
N = 14
Considere o gráfico abaixo.
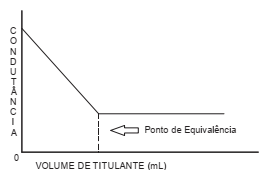
Esse gráfico representa uma titulação condutométrica cuja reação pode ser entre soluções aquosas de
Excesso de ferro no solo pode atrofiar o crescimento de algumas espécies de plantas. Espécies como a Sophora tomentosa, popularmente conhecida como feijão-da-praia, têm seu crescimento comprometido caso o solo tenha porcentagem de ferro (III) acima de 40%. Como forma de avaliar a qualidade do solo para a plantação de feijão-da-praia, foi realizada análise em uma amostra de 0,97 g de solo, devidamente coletado, contendo ferro (II) e (III). O laboratorista realizou os seguintes procedimentos:
1º. Oxidou todo ferro (II) a ferro (III) na presença de ácido nítrico.
2º. Precipitou o ferro (III), com excesso de hidróxido de amônio, a óxido de ferro hidratado (Fe2O3.xH2O).
3º. Filtrou o precipitado com cuidado.
4º. Lavou, calcinou e pesou o precipitado, obtendo 0,496g de óxido de ferro (III).
Após realizar essas etapas, emitiu o laudo que atestava:
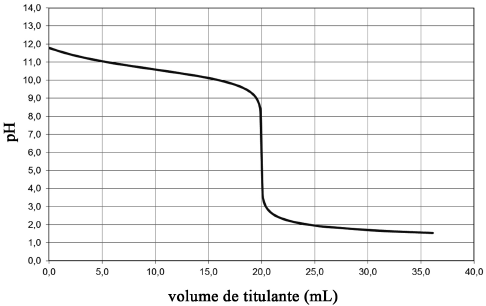
Uma amostra de 50 mL de água recolhida de um aquário contendo
dezenas de peixes mortos foi titulada com ácido clorídrico
0,01 mol/L. A curva do pH × volume de HC obtida para essa
titulação é mostrada acima. A partir dessas informações
e considerando que, nessa amostra de água, apenas uma das
substâncias — para as quais os valores das constantes de
dissociação ácida (Ka) ou básica (Kb) são fornecidos — está
presente, assinale a opção que indica, corretamente, a substância
titulada.
obtida para essa
titulação é mostrada acima. A partir dessas informações
e considerando que, nessa amostra de água, apenas uma das
substâncias — para as quais os valores das constantes de
dissociação ácida (Ka) ou básica (Kb) são fornecidos — está
presente, assinale a opção que indica, corretamente, a substância
titulada.
Com base nas informações, tem-se que o(a)
Em um laboratório de química analítica, um estudante encontrou um frasco com uma solução contendo, o seguinte rótulo: “cátion do grupo IV”. Para rotular corretamente, o aluno realizou alguns testes com alguns reagentes comuns para identificação de cátions do grupo IV e fez as seguintes observações:
1º) Ao fazer o teste utilizando solução de amônia, nenhum precipitado foi observado;
2º) Empregando uma solução de carbonato de amônio, um precipitado de cor branca foi formado, sendo este solúvel em ácidos minerais diluídos;
3º) Após utilizar ácido sulfúrico diluído, ocorreu a precipitação de um sólido branco, pesado e finamente dividido, que foi praticamente insolúvel em água.
Com base nos testes e observações do
estudante, o cátion presente no frasco mal
rotulado é?
A determinação da concentração de íons cloreto em águas é um importante parâmetro para se medir sua qualidade. Íons cloreto reagem com íons prata, gerando o cloreto de prata insolúvel.
Dados: M (g.mol-1 ): Ag = 108; Cl = 35,5; N = 14; O = 16.
A partir da estequiometria da reação de precipitação do cloreto de prata, a massa de nitrato de prata necessária para reagir com 250 mL de uma amostra contendo 250 mg.L-1 de íons cloreto é:
NaHCO3(s) + HC2 H3 O2(aq) → NaC2 H3O2(aq) + H2 O(l) + CO2(g)
Nessa reação, o