Questões de Concurso
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.034 questões
3 C2H2O4 + 2 MnO4 − ⇌ CO3 2− + 2 MnO2 + 3 H2O + 5 CO2
Considere que, na titulação de 10 mL de uma solução de ácido oxálico pelo método descrito anteriormente, tenham sido consumidos 25 mL de uma solução de KMnO4 0,0100 mol/L. Nesse caso, a concentração em quantidade de matéria de ácido oxálico na solução-problema é de
O ácido sulfúrico puro é um líquido corrosivo e extremante solúvel em água. Para diluí-lo, basta despejá-lo em um recipiente e depois, lentamente, ir adicionando água.
Considerando os riscos de manipulação, essa afirmação está
Assinale a alternativa que contém, respectivamente, as concentrações dos íons cálcio e cloreto na solução diluída.
Assinale a alternativa que contém a resposta CORRETA.
H2 O2(aq) + 2I- (aq) → I2(aq) + 2H2 O(l)
Para tal, 1,00 mL de amostra comercial de água oxigenada foi diluída para 100,00 mL com água pura. O ponto de equivalência da titulação foi alcançado com 32,00 mL de solução do titulante.
A concentração de H2 O2 , em mol L-1 , na amostra comercial é
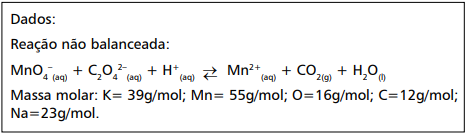
A molaridade dessa solução de KMnO4 é
HARRIS D. C. Análise Química Quantitativa. 6ª edição. Rio de Janeiro: LTC, 2005.
Durante estudo sobre erro do indicador, o analista fez uma titulação de 10,00mL de Ácido fraco (HA) 0,100mol/L (pka = 4,8) com NaOH 0,100mol/L e obteve um volume final de 9,80mL de base. O quadro abaixo apresenta três indicadores e suas faixas de viragem.
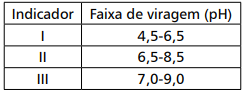
Para que o analista tenha observado esse ponto final, o(s) indicador(es) utilizado(s) foi/foram apenas
Dados: Log 49 = 1,7
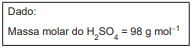
Em um laboratório, deseja-se preparar 4 L de solução aquosa de H2 SO4 com pH igual a 2 a 25ºC. Admitindo-se a ionização total de ácido, a massa de soluto, em gramas, a ser utilizada no preparo da solução é igual a

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Se a curva de titulação tivesse apenas um ponto de inflexão
negativa, então seria correto concluir que a amostra conteria
apenas NaOH.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Ácidos fracos podem ser determinados por titulometria de
neutralização, mas não os ânions deles derivados.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
A amostra em apreço contém apenas NaOH e Na2CO3.
Considere que, em uma determinação de alumínio por volumetria de complexação com ácido etilenodiaminotetracético (EDTA), em uma série de nove replicatas de uma amostra que contém 10,77% de Al2O3, chegou-se a uma média da porcentagem de Al2O3 de 10,79% e um desvio padrão de 0,0415%. Sabendo que o parâmetro t de Student para 95% de confiança e oito graus de liberdade é dado por t95 = 2,31, julgue o item seguinte, com relação a essa situação hipotética.
Uma das vantagens de utilizar EDTA como agente
complexante em volumetria de complexação é que ele é um
quelante muito seletivo.
Um extrato hidroalcóolico rico em canabinoides foi entregue ao laboratório para verificar, por meio da razão entre as concentrações de tetrahidrocanabinol (THC) e canabidiol (CBD) na amostra, se seria uma amostra medicinal ou não.
Se THC/CBD for menor que 1, a amostra não é considerada uma droga se o teor de THC for menor que 0,3% m/v. Por um erro de armazenamento, detectou-se 70% de degradação do THC e uma amostra ilícita foi liberada, pois THC/CBD deu igual a 0,9 e a concentração de THC foi de 0,3% m/v.
Os valores originais de THC e CBD, antes da degradação, eram
Para produzir alimentos em quantidade e qualidade, é necessário o uso de pesticidas ou agrotóxicos. Um pesticida bastante utilizado nas culturas de frutas e hortaliças é o herbicida 2,4-D. Considerando que essas substâncias podem deixar resíduos nos alimentos, em uma análise de 100 g de morango foram encontrados 0,10 mg desse herbicida.
De acordo com o texto, a concentração, em partes por milhão (ppm), do herbicida 2,4-D encontrada na referida análise é igual a
Uma amostra que pode conter hidróxido de sódio (NaOH), bicarbonato de sódio (NaHCO3) e carbonato de sódio (Na2CO3), isoladamente ou em misturas binárias ou ternárias, foi titulada potenciometricamente com uma solução aquosa de ácido clorídrico. A curva de titulação ácido-base experimental dessa titulação é a mostrada na figura a seguir.
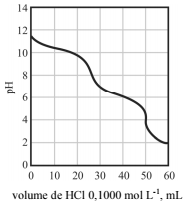
De acordo com o texto e o resultado da curva de titulação
ácido-base, é correto afirmar que a amostra em questão contém