Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 495 questões
A dissociação iônica ocorre quando os íons que já existem nas substâncias se separam em solução aquosa nos seus respectivos cátions e ânions. Esse processo é característico de compostos iônicos, como é o caso do sal cloreto de sódio:

A solubilidade é uma propriedade definida como o máximo que uma substância se dissolve em outra, formando uma mistura homogênea. A possibilidade de dissolução aumenta quando a intensidade das forças entre as moléculas de soluto e solvente é igual ou superior à intensidade das forças atrativas das partículas do soluto entre si e das moléculas do solvente entre si.

Considerando essas informações, assinale a opção correta.
Sabendo que a massa molecular do HCl é 36,5 g/mol e que o reagente concentrado possui a densidade de 1,19 g/mL e está 37%, a forma correta de preparar 100 mL do reagente diluído é:
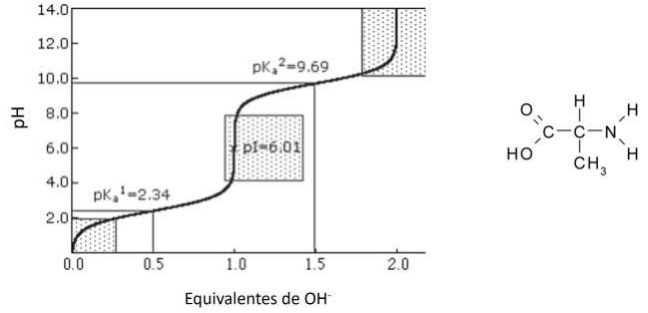
Com base no gráfico e na estrutura, marque a afirmativa INCORRETA.
A água, quando está a 25 ºC, tem pressão de vapor igual a 3 172 Pa. Adicionando-se açúcar à água, a pressão de vapor irá sofrer um ..I.. , que se observa na ..II.. da temperatura de ebulição.
Preenchem as lacunas I e II, correta e respectivamente,
Considere as soluções aquosas a seguir, todas de concentração 0,1 mol/L.
NH4OH (Kb = 1,8 × 10−5)
H3CCOOH (Ka = 1,8 × 10−5)
HF (Ka = 3,5 × 10−4)
HCN (Ka = 4,9 × 10−10)
HCℓO4 (Ka = 2,0 × 107)
O menor pH e a menor condutibilidade elétrica são observados, respectivamente, nas soluções de:
Considere as curvas de solubilidade abaixo.
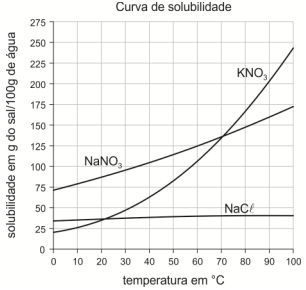
Em 100 g de água, a 20 °C, apresentará corpo de fundo uma mistura preparada com
Um professor demonstrou aos seus alunos o experimento para identificar a natureza das ligações de algumas substâncias. Submeteu a um teste de condução de corrente elétrica alguns materiais no estado sólido e após dissolvê-los em água destilada, como segue.
Frasco I: sal de cozinha.
Frasco II: açúcar.
Frasco III: solução aquosa obtida com o material do frasco I.
Frasco IV: solução aquosa obtida com o material do frasco II.
Frasco V: água destilada com a qual preparou as soluções III e IV.
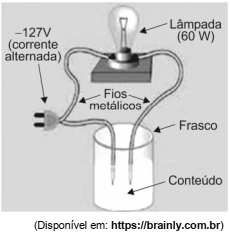
A condução de corrente elétrica capaz de acender a lâmpada é observada somente no frasco
3 C2H2O4 + 2 MnO4 − ⇌ CO3 2− + 2 MnO2 + 3 H2O + 5 CO2
Considere que, na titulação de 10 mL de uma solução de ácido oxálico pelo método descrito anteriormente, tenham sido consumidos 25 mL de uma solução de KMnO4 0,0100 mol/L. Nesse caso, a concentração em quantidade de matéria de ácido oxálico na solução-problema é de
O ácido sulfúrico puro é um líquido corrosivo e extremante solúvel em água. Para diluí-lo, basta despejá-lo em um recipiente e depois, lentamente, ir adicionando água.
Considerando os riscos de manipulação, essa afirmação está