Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 495 questões
reação 1: HCO2H (l) + H2O (l) ⇌ H3O+ (aq) + HCO2 – (aq) reação 2: CH3NH2 (l) + H2O (l) ⇌ CH3NH3 + (aq) + OH– (aq)
A partir dessas informações, assinale a opção que apresenta os pares conjugados ácido/base para as reações 1 e 2, respectivamente, considerando a reação direta, ou seja, o reagente ácido e sua respectiva base conjugada.
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
A partir dessa informação, considere que uma pessoa com massa corporal de 70 kg tenha doado sangue em um hemocentro. Sabendo-se que M (C6H12O6) = 180 g/mol, que o volume retirado de sangue correspondeu a 9 mL/kg e que o nível de glicose nesse sangue é de 0,80 mg/mL, é correto afirmar que foram doados por este paciente
Com base no exposto, são feitas as seguintes afirmações:
I. Os indicadores são compostos adicionados que sofrem uma alteração de cor ou turbidez sinalizando que o ponto final foi atingido. II. Os requisitos de um padrão primário são: alta pureza, baixa solubilidade no meio de titulação, massa molar razoavelmente alta e estabilidade à atmosfera. III. O ponto final de uma titulação de 1,00 mol de HCl é alcançado com a adição de 1,00 mol de Mg(OH)2.
Está(ão) corretas(s) a(s) afirmativa(s)
Os grupos das aulas experimentais de Química utilizaram titulação de complexação para determinar a concentração de ferro numa amostra. Os resultados obtidos estão na Tabela abaixo.

Após a realização do cálculo é correto afirmar que a concentração média e o desvio-padrão de ferro na amostra são, respectivamente,
Observe o gráfico com curvas hipotéticas de solubilidade de sais em água em diferentes temperaturas.
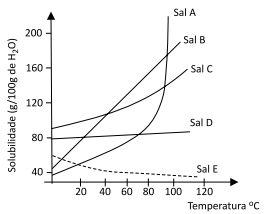
Conforme o gráfico, o fenômeno exotérmico de dissolução é observado no Sal
Um estudante misturou, acidentalmente, dois frascos de solução aquosas básicas, uma de 300 mL de hidróxido de sódio 0,2 mol/L e outra de 100 mL de hidróxido de potássio.
Considerando que a concentração de íons hidróxidos na mistura foi de 0,3 mol/L, é correto afirmar que a razão entre as concentrações, em mol por litro, dos íons K+ e Na+ após a mistura é igual a
Considerando que a viragem ocorreu após consumir 20 mL do ácido, em porcentagem, qual é o grau de pureza aproximado do hidróxido de sódio?
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item
ma substância cujas soluções aquosas contêm íons é
chamada de eletrólito. Uma substância que não forma
íons em solução é chamada não eletrólito. Por exemplo,
as diferenças entre soluções contendo cloreto de sódio
e sacarose devem‐se, em grande parte, ao fato de o NaCl
ser iônico, enquanto o C12H22O11 é molecular.
Julgue o item, relativos a ácidos e bases.
Um exemplo simples de uma reação ácido‐base é a
reação de um próton com o íon hidróxido. Nessa reação,
o íon hidróxido é um ácido de Lewis porque recebe o par
de elétrons que se torna compartilhado com o
hidrogênio.
Julgue o item, relativos a ácidos e bases.
Pela definição de Brønsted‐Lowry, um ácido é uma
substância doadora de prótons em água e uma base é
uma substância receptora de prótons em água. Pela
definição de Lewis, um ácido é uma substância que pode
doar um par de elétrons para formar uma ligação. Uma
base de Lewis é definida como uma substância que pode
aceitar um par de elétrons para a formação de uma
ligação covalente.
A respeito de soluções e concentração de soluções, julgue o item
O tipo de composição porcentual de um reagente sempre deve estar especificado explicitamente. O erro potencial resultante de uma opção incorreta é considerável. Por exemplo, para uma solução de hidróxido de sódio comercial a 50% (m/m), sua concentração corresponde a 50% (m/v) de hidróxido de sódio.A respeito de soluções e concentração de soluções, julgue o item
As três formas de expressar a concentração em termos
de porcentagem, a saber, porcentual em massa,
porcentual em volume e porcentual em massa/volume,
apresentam a característica de serem independentes da
temperatura.
A respeito de soluções e concentração de soluções, julgue o item
O porcentual em massa/volume é geralmente utilizado para indicar a composição de soluções aquosas diluídas de reagentes sólidos. Desse modo, o nitrato de potássio a 5% aquoso normalmente se refere a uma solução preparada pela solubilização de 5 g de KNO3 em água suficiente para perfazer 100 mL de solução.A respeito de soluções e concentração de soluções, julgue o item
O porcentual em volume é comumente utilizado para
especificar a concentração de um soluto preparado pela
diluição de um composto líquido puro em outro líquido.
A respeito de soluções e concentração de soluções, julgue o item
Em termos de porcentual em massa, um reagente aquoso comercializado como uma solução a 70% contém 70 g de reagente para cada 100 g de solvente.