Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.135 questões
Reações de neutralização são reações entre um ácido e uma
base que produzem sal e água, de acordo com os conceitos de
Arrhenius. O sal inorgânico formado é então um produto iônico
dessa reação que ao ter contato com a água é dissolvido liberando
no mínimo um cátion diferente de H+ e no mínimo um ânion
diferente de OH-. Considerando a dissolução de um sal em uma
solução aquosa neutra, assinale a alternativa correta.
As figuras a seguir ilustram quatro curvas de titulação volumétrica de neutralização (A, B, C e D), envolvendo ácidos e bases de concentrações iguais.
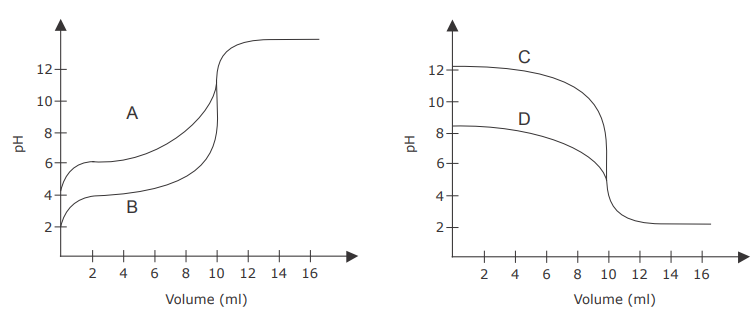
Em relação às curvas de titulação da figura, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A curva "A" representa a titulação de um ácido fraco com uma base forte.
( ) A curva "B" representa a titulação de um ácido muito fraco com uma base forte.
( ) A curva "C" representa a titulação de uma base fraca com um ácido forte.
( ) A curva "D" representa a titulação de um ácido fraco com uma base forte.
A sequência correta é
Para a determinação colorimétrica de um composto "X" na faixa de concentração de 1 a 8 mg/L, um analista realizou a medida de absorvância para 4 padrões em um colorímetro de bancada. A curva de calibração preparada pelo analista pode ser visualizada na figura.
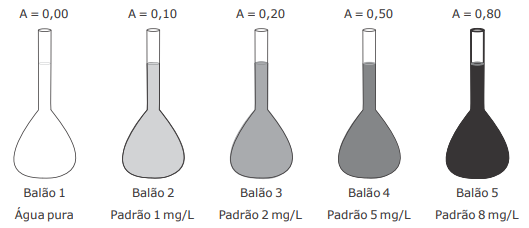
Sabendo que a análise do composto "X" deve apresentar absorvância no intervalo entre 0,10 e 0,80 e que o
rótulo da amostra contendo o composto "X" indica uma concentração de 2000 mg/L, considere as afirmativas
a seguir.
I - A amostra precisa ser diluída 100 vezes para que possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
II - 1 mL da amostra deve ser pipetado em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
III - 5 mL da amostra devem ser pipetados em um balão volumétrico de 500 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
IV - 1 mL da amostra deve ser pipetado em um balão volumétrico de 250 mL e o volume aferido com água desionizada, para que essa amostra possa ser medida pelo método colorimétrico proposto no intervalo de concentração e absorvâncias mostrado na figura.
Está(ão) correta(s)
SOLUÇÃO 1 - 10 mL da solução estoque (2,010 mol/L) foi pipetado e transferido para um balão volumétrico de 100 mL, onde o volume foi completado com água desionizada.
SOLUÇÃO 2 - 5 mL da SOLUÇÃO 1 foi pipetado e transferido para um balão volumétrico de 50 mL, onde o volume foi completado com água desionizada.
As concentrações finais da SOLUÇÃO 1 e SOLUÇÃO 2 são, respectivamente,
Resíduos de metais pesados gerados em laboratório químico podem ser tratados por reação de precipitação com carbonato, geralmente na forma de calcário. O sólido obtido é filtrado em papel e armazenado, sendo que o líquido filtrado é neutralizado antes do descarte. Para a separação de resíduos dos íons metálicos Pb2+ , Cd2+ e Cu2+, a precipitação ocorre de acordo com as seguintes reações:

Em relação às reações de precipitação e seus produtos de solubilidade (Kps), considere as afirmativas a seguir.
I - Cu2+ é o íon mais insolúvel da mistura na precipitação com íon 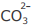
II - Pb2+ é o íon mais solúvel da mistura na precipitação com íon 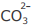
III - Cd2+ é mais insolúvel do que Cu2+ e Pb2+ na
precipitação com íon 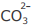
Está(ão) correta(s)
A dureza da água é definida pela quantidade de alguns íons dissolvidos, como carbonatos, sulfatos, cálcio e magnésio. Para a determinação da dureza total, faz-se necessária a determinação destes íons de maneira seletiva. Como exemplo, a determinação de íons Ca2+ em águas envolve com frequência a titulação complexométrica com o reagente etilenodiaminotetra-acetato dissódico (Na2 EDTA).
Com esse propósito, um químico preparou uma solução do sal Na2EDTA di-hidratado (peso molecular = 372,0 g) pela dissolução de 0,140 g em 250 mL de água desionizada.
Com relação a essa solução preparada, qual sua concentração molar (mol/L)?
I - A concentração molar da solução de íon Fe2+ é 0,0005 mol/L.
II - A concentração molar da solução de FeSO4.7H2O é 0,005 mol/L.
III - A concentração percentual (massa/volume) da solução de íon Fe2+ é 13,9%.
IV - A concentração percentual (massa/volume) da solução de FeSO4.7H2O é 0,139%.
Está(ão) correta(s)
Para a conservação de carnes, uma estratégia usada desde a Antiguidade é o uso de salmoura, solução de NaCl em água, em concentrações de sal, que pode variar de 10 a 30%.
Considerando que a osmose seja o principal processo responsável pela conservação da carne, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A solução é considerada hipotônica em relação às células.
( ) Há fluxo de água do interior das células para o meio externo a elas.
( ) As células vão desidratar e encolher.
A sequência correta é
Qual a massa de KMnO4, em gramas, que deve ser pesada para a preparação dessa solução?
Para uma amostra de carvão, que vai utilizar a técnica aberta ou fechada, quais os ácidos indicados para esse tipo de digestão ácida?
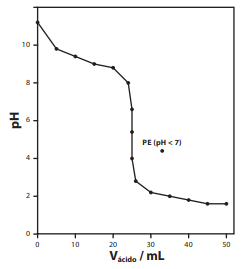
O gráfico representa uma titulação de:
■ NaOH ■ NaHSO4 ■ Na2CO3 ■ CH3CH2OH ■ C5H9CONH2
Qual das substâncias acima é a mais adequada para realizar o tratamento do resíduo?
Os seguintes dados foram obtidos para uma curva de calibração:
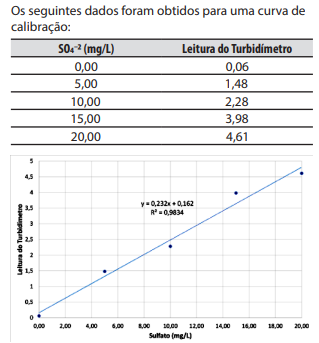
Indique a concentração de sulfato em uma amostra que gerou uma leitura de 2,84 no turbidímetro.