Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.135 questões
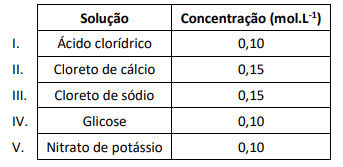
A solução que apresenta o menor efeito crioscópico é a
Dados: massas molares (g.mol-1): S =32; Fe=56.
Se 44kg de sulfeto de ferro(II) contendo impurezas inertes produziram 6,8kg de gás sulfídrico, a porcentagem de pureza desse sulfeto é de
Assinale a opção que indica os ácidos causadores da diminuição do pH da chuva.
O quadro a seguir apresenta as concentrações de cinco soluções ideais obtidas com diferentes solutos totalmente dissociados.
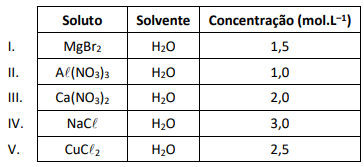
A solução que apresenta a menor pressão de vapor é a
Assinale a opção que indica a concentração de cloreto de sódio nessa água, em ppm.
Com relação às propriedades de tais substâncias, e considerando a teoria de Arrhenius, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Em solução aquosa, ácidos liberam prótons H+ e bases liberam ânions H- . ( ) Quando colocados em água, ácidos sofrem ionização e bases, dissociação iônica. ( ) Os ácidos são líquidos corrosivos e perigosos, por isso não podem entrar em contato com a pele nem ser ingeridos.
As afirmativas são, respectivamente,
2HCl (aq) + CaCO3 (s) → CaCl2 (aq) + H2O (l) + CO2 (g)
Pensando nas condições normais de temperatura e pressão (CNTP), vamos calcular a massa de água, em gramas, e o volume de gás carbônico, que pode se formar a partir de 80g de carbonato de cálcio. Dados as massas atômicas de Ca= 40; C = 12; O=16. Assinale a alternativa que apresenta os valores encontrados.
O Regulamento Técnico SVS/MS nº 540/1997 considera o fermento químico como um aditivo, e como tal, necessita obrigatoriamente ser registrado na ANVISA de acordo com as orientações da Resolução nº 23 (ANVISA, 2000).
Basicamente, os fermentos químicos são constituídos de uma mistura de pirofosfato ácido de sódio, bicarbonato de sódio e fécula de mandioca. Além do conhecido bicarbonato de sódio, assinale a alternativa que apresente alguns ácidos que podem fazer parte da composição.
ma(Ca) = 40u, ma( C) =12u, ma(O)= 16u, ma( C
 ) = 35,5u, ma(Na) = 23u, ma(H)=1u.
) = 35,5u, ma(Na) = 23u, ma(H)=1u. É CORRETO afirmar que
I. Na preparação de uma solução aquosa envolvendo um soluto sólido, esse (soluto) deve ser inicialmente dissolvido em um béquer, utilizando-se um volume de solvente inferior ao volume final da solução a ser preparada.
II. Para se diluir uma solução concentrada de ácido sulfúrico, acrescenta-se à solução concentrada do ácido a quantidade de água necessária à diluição pretendida.
III. Aconselha-se, ao preparar uma solução aquosa de hidróxido de sódio, dissolver diretamente em água destilada as lentilhas de NaOH(S) no próprio balão volumétrico.
IV. O erro percentual referente a um balão volumétrico de capacidade 100,0 mL, cujo limite de erro associado ao seu volume é 0,08 é igual a 0,08% .
São VERDADEIRAS as afirmativas

Com base nos dados da tabela acima, assinale o indicador que apresentará o menor erro na determinação do ponto de equivalência da titulação em questão.
Coluna I 1. Possui caráter básico. 2. Em solução aquosa se ioniza. 3. Obtém-se na reação de neutralização. 4. Utilizado pelas plantas na fotossíntese.
Coluna II
( ) Sulfato de potássio ( ) Cloreto de hidrogênio ( ) Hidróxido de magnésio ( ) Gás carbônico
A sequência correta, de cima para baixo, é:

( ) O ácido bromídrico (HBr) é um hidrácido forte. ( ) O ácido fosfórico (H3PO4) é um oxiácido forte. ( ) O ácido hipocloroso (HCℓO) é um oxiácido fraco. ( ) O ácido iodídrico (HI) é um hidrácido fraco.
Está correta, de cima para baixo, a seguinte sequência:
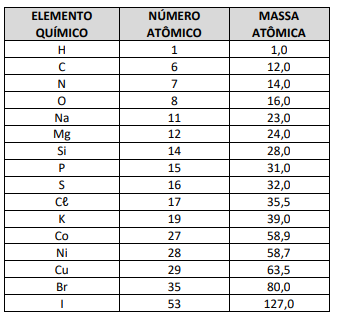
Dados: N (Z=7); O (Z=8)